Questões sobre Geral
Lista completa de Questões sobre Geral para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.

A dissolução de oxigênio na água não altera a constante de equilíbrio da reação de corrosão do ferro, mantido o pH = 7 do meio, mas acelera a velocidade dessa reação.
- C. Certo
- E. Errado
Considere os seguintes equilíbrios químicos e suas constantes KI, KII e KIII: 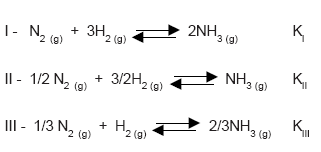 A alternativa que relaciona corretamente as constantes de equilíbrio, a uma mesma temperatura, é:
A alternativa que relaciona corretamente as constantes de equilíbrio, a uma mesma temperatura, é:
- A.
KI = KII = KIII
- B.
KI = 2KII = 3KIII
- C.
KI = KII/2 = KIII/3
- D.
KI = (KII)2 = (KIII)3
- E.
KI = (KII)1/2 = (KIII)1/3

A reação de formação da ferrugem chega ao seu final quando a velocidade de oxidação do ferro é igual à velocidade de redução do oxigênio.
- C. Certo
- E. Errado
Nos garimpos da Amazônia, o mercúrio metálico é empregado na extração de ouro e, por ser um metal de alta toxicidade com propriedades bioacumulativas, acarreta sérios danos ao meio ambiente e à saúde humana. Vários estudos têm sido realizados visando ao controle dos teores de mercúrio em águas, solos e alimentos. Em geral, a metodologia envolve um pré-tratamento da amostra, através da redução química do mercúrio para liberá-lo em sua forma metálica, de modo a proceder à determinação quantitativa do metal na matriz estudada. Dentre as técnicas analíticas abaixo, aquela adequada a determinações quantitativas de mercúrio é a:
- A.
cromatografia em coluna.
- B.
espectrofotometria de absorção atômica.
- C.
espectroscopia de absorção molecular no infravermelho.
- D.
cromatografia gasosa com detector de ionização por chama.
- E.
cromatografia gasosa acoplada à espectrometria de massas.

O ferro sólido pode reduzir a água pura em pH igual a 7.
- C. Certo
- E. Errado
Considere o diagrama de equilíbrio das fases sólida, líquida e vapor da água ilustrado esquematicamente abaixo e as afirmativas que se seguem.
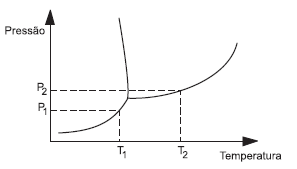
I - Um aumento da pressão externa provoca um abaixamento do ponto de fusão do sólido.
II - Uma diminuição de pressão externa provoca uma elevação no ponto de ebulição do líquido.
III - A pressão P1 corresponde à pressão de vapor do líquido na temperatura T1.
IV - A pressão P2 corresponde à pressão de vapor do líquido a temperatura T2.
Estão corretas apenas as afirmações
- A.
I e II.
- B.
I e III.
- C.
I e IV.
- D.
II e III.
- E.
II e IV.

Considerando as informações acima e sabendo que M(C) = 12 g/mol e M(H) = 1 g/mol, julgue os itens seguintes.
Sabendo que o benzeno e o tolueno formam uma solução ideal e que as respectivas pressões de vapor, a 25 oC, são 95 mmHg e 24,5 mmHg, então a pressão de vapor do benzeno de uma solução dessas duas substâncias, com fração molar de tolueno igual a 0,2, é maior que 20 mmHg.
- C. Certo
- E. Errado
O teor de cobre em uma amostra de sal de cobre II foi determinado por titulação de oxirredução indireta utilizando-se o seguinte procedimento: uma amostra com 3,0 g do sal foi dissolvida em água deionizada e avolumada em balão volumétrico de 250 mL. Uma alíquota de 50,00 mL foi, então, tratada com 1g de KI, conforme a reação abaixo.
Cu+2 + 2I− → Cu+1 + I2
Em seguida, o iodo liberado foi convertido a I− através de titulação. O titulante adequado a esta análise é o:
- A.
K2Cr2O7.
- B. KMnO4.
- C. Ce(SO4)2.
- D. Na2S2O3.
- E.
KIO3.

Considerando as informações acima e sabendo que M(C) = 12 g/mol e M(H) = 1 g/mol, julgue os itens seguintes.
Os catalisadores empregados nas reações de síntese influenciam na lei de velocidade dessas reações, modificando a sua constante de velocidade.
- C. Certo
- E. Errado
Considere os mais simples orbitais atômicos s, p, d e f (1s, 2p, 3d e 4f). A soma total do número de planos nodais existentes nesses quatro orbitais é:
- A.
1
- B.
3
- C.
5
- D.
6
- E.
7


