Questões sobre Reações, Soluções e Transformações Químicas
Lista completa de Questões sobre Reações, Soluções e Transformações Químicas para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) - 2014
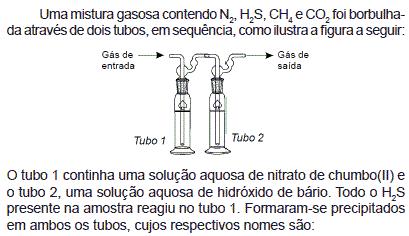
- A. sulfato de chumbo II e carbonato de bário
- B. sulfeto de chumbo II e carbeto de bário
- C. sulfi to de chumbo II e carbonato de bário
- D. sulfeto de chumbo II e carbonato de bário
- E. sulfato de chumbo II e carbeto de bário
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2014
Uma mistura contendo os compostos orgânicos naftaleno, etilenoglicol, ácido benzoico e anilina foi separada por meio de técnicas apropriadas, de acordo com o esquema ilustrado abaixo.
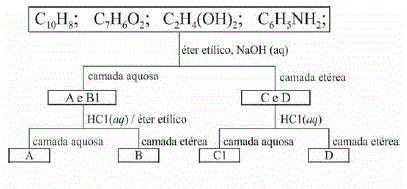
A partir do esquema, julgue os seguintes itens.
As interações atrativas tendem a ser grandes entre moléculas semelhantes, dado que semelhante dissolve semelhante, porém o momento dipolar, um dos fatores que determinam a solubilidade, é característico de todas as moléculas.- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) - 2014

- A. aumentar a pressão
- B. aumentar a temperatura
- C. diminuir a pressão
- D. diminuir a temperatura
- E. adicionar catalisador
Química - Reações, Soluções e Transformações Químicas - Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) - 2014
A entalpia padrão de combustão (ΔHC °) de uma substância pode ser determinada experimentalmente em um calorímetro de bomba. Um aparelho desses foi calibrado e sua capacidade calorífi ca determinada foi de 641J.K-1. Ao se promover a queima de 0,64g de glicose (C6H12O6) no calorímetro, nas condições-padrão, a temperatura aumentou de 15,6K. Então, pode-se afi rmar que ΔHC ° da glicose, em kJ.mol-1, é aproximadamente igual a:
- A. +2800
- B. -2800
- C. +1000
- D. -1000
- E. - 3600
Química - Reações, Soluções e Transformações Químicas - Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) - 2014
O arsênio é um elemento químico muito tóxico que, no estado de oxidação +3, é letal para os humanos em doses de 140mg ou mais. É encontrado principalmente nos minerais arsenopirita, realgar e orpimento, que são sulfetos desse elemento. A reação entre sulfeto de arsênio III, ácido nítrico e água produz ácido sulfúrico, ácido arsênico e óxido nítrico gasoso. Após escrever a equação química completa e balanceada, a soma de todos os menores coefi cientes estequiométricos inteiros é igual a:
- A. 60
- B. 78
- C. 58
- D. 80
- E. 70
Química - Reações, Soluções e Transformações Químicas - Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) - 2014
A variação de energia livre de Gibbs (ΔG) é uma medida da variação total de entropia de um sistema e suas vizinhanças, à pressão e temperatura constantes e prevê a espontaneidade da ocorrência de um processo, de acordo com a segunda Lei da Termodinâmica. Cinco reações químicas, numeradas por I, II, III, IV e V, cujas variações de entalpia (ΔH) e entropia (ΔS) são conhecidas, devem ser escolhidas para sua realização à mesma temperatura. São mostrados a seguir os dados relativos a cada uma das reações: Reação I - ΔH positivo e ΔS negativo, sendo que o ΔS multiplicado pela temperatura gera um valor numérico menor que o do ΔH. Reação II - ΔH positivo e ΔS positivo, sendo que o ΔS multiplicado pela temperatura gera um valor numérico menor que o de ΔH. Reação III - ΔH positivo e ΔS negativo, sendo que o ΔS multiplicado pela temperatura gera um valor numérico maior que o de ΔH. Reação IV - ΔH negativo e ΔS negativo, sendo que o ΔS multiplicado pela temperatura gera um valor numérico maior que o de ΔH. Reação V - ΔH positivo e ΔS positivo, sendo que o ΔS multiplicado pela temperatura gera um valor numérico maior que o de ΔH. Segundo dados exclusivamente termodinâmicos, a reação a ser escolhida é a de número:
- A. I
- B. II
- C. III
- D. IV
- E. V
Química - Reações, Soluções e Transformações Químicas - Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) - 2014

- A. 611
- B. 6,11
- C. 6110
- D. 1222
- E. 12,22
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2014
Com relação às substâncias encontradas na natureza e suas transformações, julgue os itens a seguir. O carbeto de cálcio (CaC2) pode reagir com a água e originar o acetileno, que, por sua vez, pode ser utilizado para iluminar um ambiente caso haja dispositivo adequado para a queima do gás.
- C. Certo
- E. Errado

- A. água destilada, isenta de CO2, o pH do meio aumenta, pois o equilíbrio é deslocado no sentido de formar mais H3O+.
- B. HCl(aq) 1,0 mol/L, o equilíbrio é deslocado para a direita no sentido de aumentar a concentração de C2H3O2 -, o que acarreta a diminuição do pH.
- C. HCl(aq) 1,0 mol/L, aumenta a concentração de H3O+, e o pH do meio se eleva significativamente.
- D. NaOH(aq) 1,0 mol/L, íons OH- consomem íons H3O+, acarretando leve aumento do pH do meio com o equilíbrio sendo deslocado para a direita.
- E. NaOH(aq) 1,0 mol/L, íons Na+ se unem fortemente aos íons C2H3O2 - diminuindo o pH do meio.

- A. 24,81%
- B. 36,18%
- C. 51,68%
- D. 62,01%
- E. 72,35%


