Questões sobre Reações, Soluções e Transformações Químicas
Lista completa de Questões sobre Reações, Soluções e Transformações Químicas para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.

- A.
I e S
- B.
I e H
- C.
H e O
- D.
O e I
- E.
S e I

- A.

- B.

- C.

- D.

- E.

Durante o processo de produção de petróleo, é comum o aparecimento de gás e água associados. A separação dessas fases é necessária em função do uso do gás na indústria. A água, por apresentar elevado teor de sal em sua composição e formar emulsões com viscosidades superiores à do petróleo desidratado, deve ser removida, pois
- A. afeta o dimensionamento do sistema de bombeio e transferência.
- B. afeta a temperatura de transferência pelo aumento da pressão de vapor.
- C. dilui as frações mais leves, diminuindo a qualidade do petróleo.
- D. pode reagir quimicamente com o petróleo, causando entupimento nos dutos.
- E. reduz a produtividade da destilação, porque forma sais corrosivos para a torre de fracionamento.

- A.
90
- B.
100
- C.
500
- D.
900
- E.
1.000
De acordo com o conceito de Arrhenius, substâncias ácidas, na presença de água,
- A.
liberam íons OH- e não liberam íons H+.
- B.
liberam íons H+ e não liberam íons OH-.
- C.
liberam íons H+ e OH-.
- D.
não sofrem ionização.
- E.
liberam CO2.
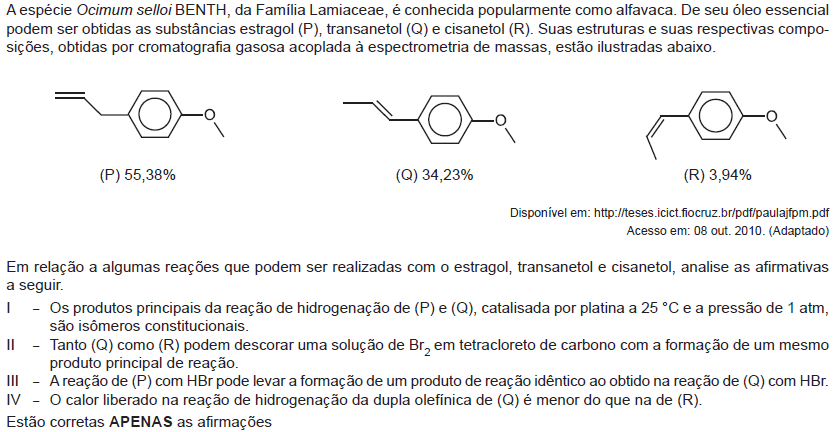
- A.
I e IV.
- B.
II e III.
- C.
III e IV.
- D.
I, II, e III.
- E.
I, II e IV.
O fogo surgiu junto à tomada elétrica de piso da sala, próximo à lixeira de papel. Havia vários computadores funcionando, ligados àquela tomada através de um dispositivo improvisado. Naquela sala, a ventilação natural era propiciada por amplas janelas, por onde entrava o vento em corrente. Dois equipamentos estavam disponíveis para o combate àquele princípio de incêndio: ambos eram aparelhos portáteis, sendo, o primeiro, de dióxido de carbono, e o outro, de pó químico. Da equipe de trabalho naquele local, no momento, fazia parte um Técnico em Logística de Transporte que pertencia à Brigada de Incêndio da unidade de negócios. Imediatamente ele definiu, com êxito, o segundo dos aparelhos disponíveis, como o mais eficaz para a extinção daquele pequeno foco de fogo porque apresentava as vantagens de
- A.
manter a temperatura do local, sem interferir no processo de resfriamento do ponto de origem do fogo que, assim, extingue-se de forma gradual por abafamento.
- B.
sofrer menos influência da corrente de ar existente em seu agente extintor, e apagar o fogo com maior velocidade por interferir diretamente na reação em cadeia do fogo.
- C.
umedecer o local e deixar pouco resíduo prejudicial na posterior operação de rescaldo ou na recuperação dos equipamentos expostos à sua ação durante o combate ao fogo.
- D.
ser mais suscetível à aerodispersão do pó químico, o que gera resfriamento numa área mais extensa, além de o fato do extintor de pó químico ser mais pesado que o dióxido de carbono.
- E.
ser volátil, misturando-se com o ar atmosférico e, assim, ser mais facilmente transportado na corrente de ar, até o ponto onde estão surgindo as chamas, que logo se retraem.
Uma solução de uma dada amostra apresenta absortividade de 200 Lmol1cm1. Foi analisada por espectroscopia na região do UV/Vis em um comprimento de onda na qual se obedece à lei Lambert Beer na concentração empregada nesse experimento. Considere que o caminho óptico é de 1 mm, e a absorbância observada é 0,4. Empregando esse resultado na equação de Lambert-Beer, conclui-se que a concentração da amostra é, aproximadamente,
- A.
0,01 molL1
- B.
0,02 molL1
- C.
0,002 molL1
- D.
8,0 molL1
- E.
80 molL1
Ao se eliminar a presença do oxigênio num ambiente onde está ocorrendo um princípio de incêndio, proporciona-se a descontinuidade da existência do Triângulo do Fogo no local. A consequência desse fato é a(o)
- A.
extinção do fogo por abafamento.
- B.
queima somente do material orgânico no ambiente.
- C.
transformação do fogo em incêndio.
- D.
alastramento do fogo para onde haja mais combustível.
- E.
risco de explosão por insuficiência de comburente.
Para se determinar o teor de cloreto em 1 litro de uma solução salina pelo método de Volhard, retirou-se uma alíquota de 25 mL da mesma, que foi tratada com 40 mL de uma solução padrão de nitrato de prata com concentração 0,150 M. Após a precipitação quantitativa do cloreto na forma de AgCl, titulou-se o excesso de prata remanescente com uma solução padrão de KSCN 0,200 M, contendo íons Fe3+ como indicador. O volume de titulante gasto para se atingir o ponto de equivalência foi de 5 mL. Com base nesses dados, conclui-se que a massa de cloro presente na forma de cloreto na solução inicial é, aproximadamente, de
- A.
0,2 g
- B.
1,0 g
- C.
5,0 g
- D.
6,0 g
- E.
7,0 g


