Questões sobre Reações, Soluções e Transformações Químicas
Lista completa de Questões sobre Reações, Soluções e Transformações Químicas para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
Um determinado metal puro hipotético possui densidade aproximada de 8 gramas por cm3. Sabendo que a massa de 1 mol deste elemento químico é de aproximadamente 64 gramas, pode-se afirmar que o número de átomos presentes em uma peça de forma cúbica com 2cm de aresta feita deste metal é de aproximadamente:
- A.
2 × 1022
- B.
4 × 1022
- C.
6 × 1023
- D.
8 × 1023
- E.
8 × 1024
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
A flotação é uma operação de concentração mineral que explora as propriedades de interface dos minerais. A adequada adição e adsorção de reagentes químicos como coletores, depressores, ativadores e espumantes numa célula de flotação conduz para:
- A.
separação seletiva dos minerais com caráter hidrofóbico dos minerais com caráter hidrofílico;
- B.
perda de seletividade mineral;
- C.
impedimento da separação do mineral de interesse em relação aos minerais da fase ganga;
- D.
formação de diversas frações granulométricas;
- E.
formação de um conjunto de minerais silicatados.
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
A concentração gravimétrica é fundamentalmente baseada na relação de queda livre ou impedida entre dois minerais, destacando-se a:
- A.
diferença de forma das partículas do mineral de interesse e dos minerais formadores da fase ganga;
- B.
diferença significativa entre a densidade do mineral de interesse e dos minerais da fase ganga;
- C.
susceptibilidade magnética dos minerais que constituem o minério;
- D.
forma das partículas minerais não liberadas;
- E.
cominuição seletiva de um minério.
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
A cominuição consiste na redução gradual do tamanho de um minério proveniente de uma mina e controle na produção de frações granulométricas do mesmo, podendo levar à liberação de um mineral de interesse do minério. Esta liberação consiste em:
- A.
gerar uma assembléia de partículas com tamanhos diferentes;
- B.
gerar uma assembléia de partículas contendo cada uma delas, predominantemente, uma fase mineral;
- C.
separar o mineral de interesse dos minerais que compõem a ganga;
- D.
reduzir o tamanho das partículas de um minério;
- E.
gerar uma assembléia mineral contendo partículas de diversos tamanhos e formas.
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
A ionização do H2SO4 em água produz as seguintes reações de equilíbrio:
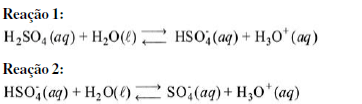
Segundo a teoria de ácidos e bases de Brönsted-Lowry, as espécies a seguir podem ser definidas como:
- A.
HSO4 − como ácido na Reação 1 e na Reação 2;
- B.
H2O como ácido Reação 1 e como base na Reação 2;
- C.
H3O+ como ácido Reação 1 e como base na Reação 2;
- D.
HSO4 − como base na Reação 1 e como ácido na Reação 2;
- E.
H2SO4 como ácido Reação 1 e H3O+ como base na Reação 2.
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
Um dos riscos da utilização do hidrogênio como combustível veicular é sua liberação acidental, pois a reação entre o hidrogênio gasoso e o oxigênio atmosférico é uma reação explosiva:

- A.
2 g e 32 g;
- B.
4 g e 16 g;
- C.
5 g e 80 g;
- D.
10 g e 320 g;
- E.
20 g e 160 g.
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
A reação de esterificação entre o 1-propanol e o ácido etanóico produz:
- A.

- B.

- C.

- D.

- E.

Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
O ácido nítrico (ácido forte) e o hidróxido de bário (base forte) apresentam, respectivamente, as seguintes dissociações iônicas em solução aquosa:

- A.
5,00;
- B.
10,0;
- C.
50,0;
- D.
100
- E.
200
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
A reação no estado gasoso entre as substâncias A e B pode seguir dois caminhos concorrentes de etapa única:

Deste modo, podemos estimar que:
- A.
não há favorecimento energético entre as formações de C e D;
- B.
a formação de C é favorecida cineticamente e termodinamicamente;
- C.
a formação de D é favorecida cineticamente e termodinamicamente;
- D.
a formação de C é favorecida cineticamente e a formação de D é favorecida termodinamicamente;
- E.
a formação de C é favorecida termodinamicamente e a formação de D é favorecida cineticamente.
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
Uma das etapas do processo de fabricação do ácido sulfúrico é a obtenção do trióxido de enxofre (SO3) a partir da reação em fase gasosa do dióxido de enxofre (SO2) e com o oxigênio (O2). Esta reação estabelece o equilíbrio químico:

- A.
a presença de um catalisador;
- B.
o aumento da pressão e o aumento da temperatura;
- C.
o aumento da pressão e a diminuição da temperatura;
- D.
a diminuição da pressão e o aumento da temperatura;
- E. a diminuição da pressão e a diminuição da temperatura.


