Questões sobre Reações, Soluções e Transformações Químicas
Lista completa de Questões sobre Reações, Soluções e Transformações Químicas para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
A seqüência de equações parciais de I a V, a seguir, indicam a formação da salmoura equação I e II , a eletrólise da solução e a obtenção de hidróxido de sódio como subproduto.
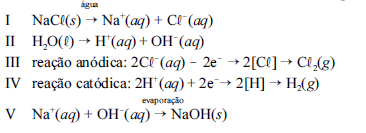
Considerando as informações acima, julgue os itens a seguir.
A reação anódica é de redução.- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008

Sabendo que a entalpia de formação do CaO (s) é igual a -635,5 kJ/mol e a do CO 2 (g) é -394 kJ/mol, é correto afirmar que a entalpia de formação do CaCO 3 (s) é igual a
- A.
–1.207 kJ/mol.
- B.
–418 kJ/mol.
- C.
+177,5 kJ/mol.
- D.
+241,5 kJ/mol.
Química - Reações, Soluções e Transformações Químicas - FUNRIO Fundação de Apoio a Pesquisa, Ensino e Assistência (FUNRIO) - 2008
O DDT é um composto químico de rápida solubilidade que pode se acumular no tecido adiposo dos animais. Numa cadeia alimentar, o DDT aumenta de concentração a cada nível trófico que se sucede. Esse fenômeno é denominado
- A. Alotropia.
- B. Biomagnificação.
- C. Biodiversidade.
- D. Ressonância.
- E. Ecossistema.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
A seqüência de equações parciais de I a V, a seguir, indicam a formação da salmoura equação I e II , a eletrólise da solução e a obtenção de hidróxido de sódio como subproduto.
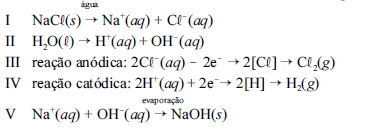
Considerando as informações acima, julgue os itens a seguir.
As etapas III e IV do processo são não espontâneas e, por isso, é necessário utilizar uma fonte externa de corrente elétrica para que as reações ocorram.- C. Certo
- E. Errado
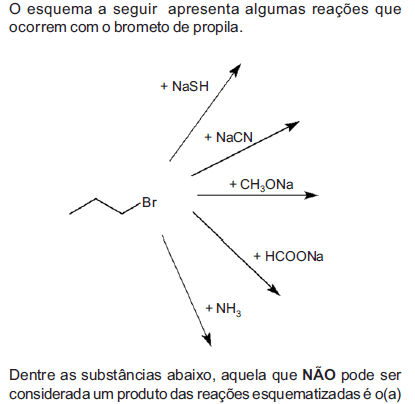
- A.
metanoato de propila.
- B.
metoxipropano.
- C.
propanonitrila.
- D.
propilamina.
- E.
propanotiol.
Química - Reações, Soluções e Transformações Químicas - FUNRIO Fundação de Apoio a Pesquisa, Ensino e Assistência (FUNRIO) - 2008
Em uma coluna de fase reversa, verificou-se que um soluto tem tempo de retenção de 31,3 min, enquanto que uma espécie não retida requer 0,48 min para eluição quando a fase móvel era constituída de 30% (em volume) de metanol e 70% de água. O fator de retenção (k') é igual a
- A. 8,7
- B. 17,4
- C. 64
- D. 128
- E. 32
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
A seqüência de equações parciais de I a V, a seguir, indicam a formação da salmoura equação I e II , a eletrólise da solução e a obtenção de hidróxido de sódio como subproduto.
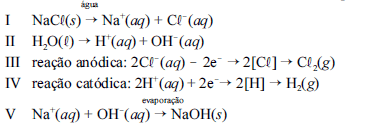
Considerando as informações acima, julgue os itens a seguir.
As equações I e II representam, respectivamente, a ionização do cloreto de sódio e a dissociação da água.- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008

- A.
Quando a chama se extingue, ocorre um abaixamento da temperatura e o ar no interior do copo se contrai fortemente, o que provoca a entrada de água no copo.
- B.
O oxigênio do ar é consumido, aumentando a pressão dentro do copo e, conseqüentemente, forçando a entrada de água para o interior do mesmo.
- C.
O produto da combustão, por ser gasoso, ocupa menor espaço que a vela sólida e a água substitui o espaço liberado pela vela consumida.
- D.
A experiência contraria a Lei de Lavoisier, pois nas reações de combustão não há conservação de massa.
Química - Reações, Soluções e Transformações Químicas - FUNRIO Fundação de Apoio a Pesquisa, Ensino e Assistência (FUNRIO) - 2008
São dissolvidos 10,0 g de sacarose (C12H22O11) em 100,0 g de água. Assinale a alternativa que indica a pressão de vapor da água (em Torr), a 20°C, nessa solução. Admita que a pressão de vapor da água pura nessa temperatura seja igual a 17,54 Torr.
- A. 0,995
- B. 18,02
- C. 8,725
- D. 17,54
- E. 17,45
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Aproximadamente 140 milhões de toneladas de gás amoníaco são produzidos anualmente pelo processo de Haber, que combina nitrogênio retirado do ar com gás hidrogênio, conforme representa a equação não-balanceada a seguir. O gás amoníaco é matéria-prima para a produção de ácido nítrico e NH4NO3, este último empregado como fertilizante e explosivo.
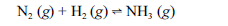
Considerando as informações acima e sabendo que M(H) = 1 g/mol e M(N) = 14 g/mol, julgue os itens a seguir.
O composto iônico de amônio empregado como fertilizante pode ser obtido conforme a equação a seguir.
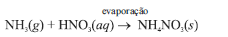
- C. Certo
- E. Errado


