Questões sobre Sistemas de equilíbrio
Lista completa de Questões sobre Sistemas de equilíbrio para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
 A constante de equilíbrio da reação entre o nitrato de prata e o cloreto de sódio, referida no texto, é menor que 1.
A constante de equilíbrio da reação entre o nitrato de prata e o cloreto de sódio, referida no texto, é menor que 1.
- C. Certo
- E. Errado
Uma corrente gasosa com vazão molar de 40 kmol/h e contendo ar e 5% molar de acetona é tratada, para remover 80% da acetona presente, em uma coluna de absorção que opera a 300 K e 101,3 kPa. A água é usada como solvente com vazão molar de 100 kmol/h. A equação de equilíbrio do sistema acetona ar água é y = 2,53x onde y e x são as composições molares da fase líquida e da fase gasosa em equilíbrio. A composição molar de acetona do produto líquido é, aproximadamente,
- A.
0,40%
- B.
1,04%
- C.
1,57%
- D.
5,00%
- E.
99,98%
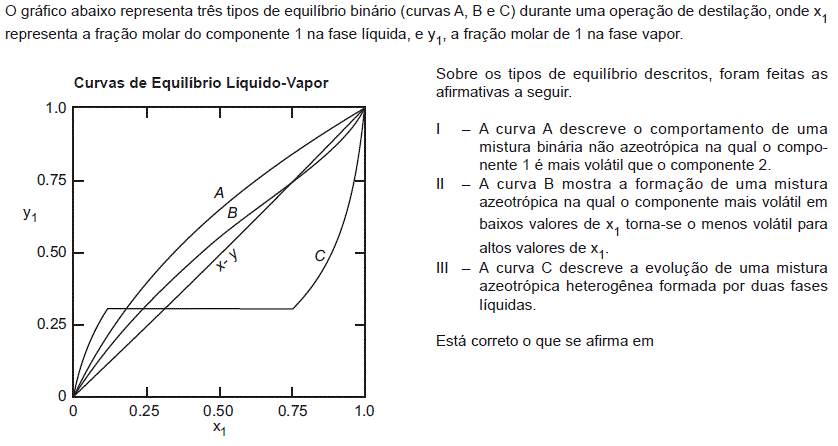
- A. I, apenas.
- B. II, apenas.
- C. I e II, apenas.
- D. II e III, apenas.
- E. I, II e III.
que não existe mais tendência a mudar a composição da mistura de reação. O estado de equilíbrio representa uma conciliação entre duas tendências opostas: entalpia versus entropia. Assinale a alternativa correta acerca desse assunto.
- A.

- B.
Na expressão da constante de equilíbrio, as concentrações dos reagentes, elevadas a uma potência igual aos seus coeficientes estequiométricos, aparecem no numerador; e as concentrações dos produtos, elevadas a uma potência apropriada, aparecem no denominador.
- C.
Quando se adicionam duas ou mais reações, suas constantes de equilíbrio devem ser somadas, a fim de se obter a constante de equilíbrio da reação total.
- D.
O pH de uma solução aquosa de um sal derivado de um ácido fraco é menor que 7.
- E.
Considerando o sistema em equilíbrio: H2(g) + Br2(g) = 2HBr(g) + 70,3kJ, a concentração do [HBr] será aumentada quando se aumentar a temperatura do sistema após estabelecer o equilíbrio.
Considerando, de uma forma simplificada, que no diagrama de equilíbrio de fases das ligas Ferro-Carbono o aço eutetoide possui 0,80%C e a solubilidade máxima de carbono no ferro alfa é praticamente nula. É correto então afirmar que um aço carbono com 0,6% de carbono, resfriado lentamente até a temperatura ambiente, em condições de equilíbrio, apresenta a seguinte microestrutura:
- A.
100% de ferrita;
- B.
100% de perlita;
- C.
25% de ferrita e 75% de perlita;
- D.
50% de ferrita e 50% de perlita;
- E.
75% de ferrita e 25% de perlita.
No Brasil, as técnicas de tratamento de água para abastecimento público contemplam, em geral, as seguintes etapas: clarificação, desinfecção, fluoretação e estabilização química. A respeito dessas etapas, julgue os itens que se seguem.
A estabilização química visa à neutralização de todos os compostos químicos utilizados nas demais etapas do tratamento da água, a fim de garantir que ela não tenha cheiro nem sabor.
- C. Certo
- E. Errado

Considerando os textos acima, julgue os itens seguintes.
Considere que o seguinte equilíbrio se estabeleça no organismo humano:
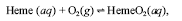
em que Heme representa o grupo heme da hemoglobina, e HemeO 2 , o complexo formado entre o grupo heme e o oxigênio. Nesse caso, a presença do CO deve deslocar o equilíbrio na direção dos produtos.
- C. Certo
- E. Errado
Em relação ao equilíbrio líquido-líquido, assinale a opção correta.
- A.
Não há influência da concentração do soluto sobre a solubilidade do solvente.
- B.
Os dados podem ser registrados, para as fases em equilíbrio, como as razões entre as massas de soluto e solvente em cada uma delas.
- C.
Duas variáveis independentes são necessárias para descrever o sistema, de acordo com a regra de fases.
- D.
Na extração em fase líquida, há transferência do soluto para uma fase mais solúvel.
- E.
Cálculos com concentrações baixas de soluto diminuem a exatidão gráfica em sistemas ternários.

Com relação às informações do texto acima, julgue os itens que se seguem.
O termo "dispersão" (L.17) refere-se a um sistema no qual partículas de tamanho coloidal estão dispersas em uma fase contínua de composição diferente daquela das partículas.
- C. Certo
- E. Errado
Considerando que um sistema mude de um estado inicial de equilíbrio para um estado final também de equilíbrio por dois processos, sendo um reversível e outro irreversível, julgue os itens a seguir.
I A variação de entropia do sistema para o processo reversível é maior que a variação de entropia do sistema para o processo irreversível.
II A variação de entropia do sistema para o processo reversível é sempre maior ou igual a zero.
III A variação de entropia total do sistema é igual a zero.
IV A variação de entropia do sistema para o processo reversível é igual à variação de entropia do sistema para o processo irreversível.
V A variação de entropia do sistema para o processo reversível pode ser menor que zero.
Estão certos apenas os itens
- A.
I e II.
- B.
I e V.
- C.
II e III.
- D.
III e IV.
- E.
IV e V.


