Questões de Química da Fundação CESGRANRIO (CESGRANRIO)
Lista completa de Questões de Química da Fundação CESGRANRIO (CESGRANRIO) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.

- A.
1,4
- B.
2,8
- C.
5,6
- D.
11,2
- E.
22,4
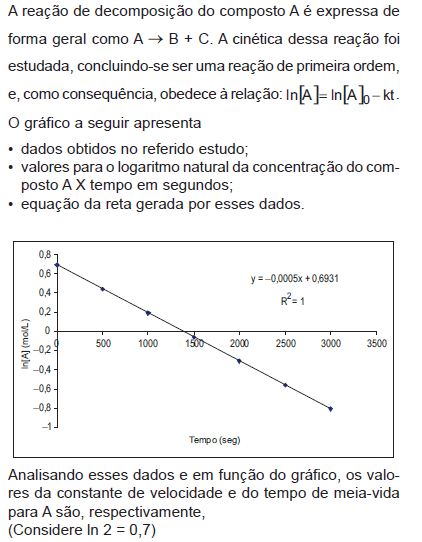
- A. 0,0005 s-1 e 1400 s
- B. 0,0005 s-1 e 0,693 s
- C. 0,693 s-1 e 0,0005 s
- D. 0,693 s-1 e 1,0 s
- E. 1,0 s-1 e 2,0 s
Considere a seguinte experiência que visa a identificar as cores presentes numa tinta: pinga-se uma gota de tinta de uma caneta hidrocor a 1 cm da extremidade de uma tira de papel de filtro. Introduz-se essa extremidade da tira de papel de filtro em um solvente (água ou álcool), sem que o solvente toque na tinta. Após alguns segundos, o solvente sobe por capilaridade e, no arraste, as diferentes cores presentes na tinta se separam. Esse método de separação é denominado
- A.
cromatografia em papel
- B.
colorimetria
- C.
evaporação seletiva
- D.
decantação
- E.
destilação fracionada
Três soluções, I, II e III, foram preparadas adicionando-se uma mesma quantidade de matéria dos seguintes solutos: solução I ureia ((NH2)2CO); solução II ácido sulfúrico (H2SO4); solução III ácido acético (CH3COOH). As três soluções foram preparadas com uma mesma massa de solvente, a saber, água. Considerando o comportamento ideal e definindo as temperaturas de início de congelamento das três soluções como: TI, TII e TIII, respectivamente, a relação entre estas temperaturas será
- A. TI = TIII< TII
- B. TI < TIII< TII
- C. TII = TIII< TI
- D. TI = TII = TIII
- E. TII < TIII< TI
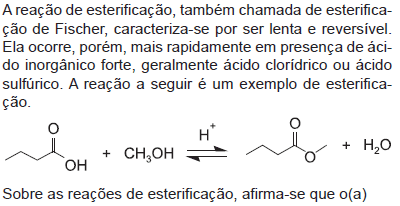
- A.
excesso de água não favorece a reação na direção do metanol.
- B.
ácido inorgânico deve ser usado em quantidade equimolecular, pois ele efetivamente participa como reagente.
- C.
álcool atua como uma espécie deficiente em elétrons que ataca o carbono do ácido.
- D.
álcool terciário, nesse tipo de reação, é mais reativo que o álcool primário.
- E.
reação na direção do metanol representa a hidrólise do éster.
Um sabão muito comum é o estearato de sódio, C17H35COO- Na+. Este composto possui uma grande cadeia carbônica, de natureza apolar, e uma extremidade iônica, de natureza polar. Essa característica confere ao sabão a capacidade de interagir com um grande número de substâncias de naturezas distintas. Em soluções aquosas, em baixas concentrações, os íons estearato e sódio ficam dispersos. Elevando essa concentração, os íons estearato se aglomeraram formando micelas. Estas micelas são carregadas e possuem o tamanho de uma partícula coloidal. Sobre essa solução onde se formaram as micelas, pode-se afirmar que:
I a condutividade elétrica da solução permanece inalterada após a formação das micelas, uma vez que não se alterou o número de cargas na solução; II a formação das micelas reduz a pressão osmótica da solução, que é dependente da quantidade de partículas presentes na solução; III as micelas podem ser separadas do resto da solução por filtração simples. Está correto o que se afirma em- A. I, apenas.
- B. II, apenas.
- C. I e II, apenas.
- D. I e III, apenas.
- E. I, II e III.
A fermentação de açúcares, como a glicose e a frutose presentes nas frutas, gera etanol através do processo de fermentação. O vinho é uma bebida que contém etanol obtido pela fermentação de substâncias presentes na uva. É comum o vinho azedar devido à presença de oxigênio no ar atmosférico. Sobre o processo de oxidação do etanol, afirma-se que a(o)
- A.
oxidação do etanol gera propanona.
- B.
oxigênio presente no ar proporciona a redução do álcool.
- C.
produto final é um aldeído, uma vez que a oxidação é parcial, por ser um processo lento e natural.
- D.
produto da oxidação completa é um ácido que possui um carbono com NOX 3+.
- E.
produto principal da oxidação é o acetato de etila.
Utilizando benzeno como solvente, foi preparada uma solução com um soluto não volátil. A determinação da temperatura de congelamento e de ebulição da solução forneceu os respectivos valores, - 4,5 oC e 85,2 oC. Considerando o comportamento ideal e conhecendo os valores de ponto de ebulição e congelamento do benzeno puro, 80,2 oC e 5,5 oC, respectivamente, tem-se que a
- A. constante crioscópica do benzeno equivale a aproximadamente 10 K.kg .mol-1, e a constante ebulioscópica do benzeno equivale a aproximadamente 2,5 K.kg .mol-1.
- B. constante ebulioscópica do benzeno é aproximadamente quatro vezes menor que sua constante crioscópica.
- C. constante ebulioscópica do benzeno é aproximadamente duas vezes menor que sua constante crioscópica.
- D. molalidade da solução preparada é de 0,5 mol.kg-1.
- E. molalidade da solução preparada é de 10,0 mol.kg-1.
Uma mistura gasosa, a 25 °C, é formada por 16,8 g de nitrogênio e 9,6 g de oxigênio e está contida em um recipiente de 2,0 L. A razão entre as pressões parciais do oxigênio e do nitrogênio no recipiente, considerando comportamento ideal para os gases, é aproximadamente
Dados: R = 0,082 L atm mol−1 K−1
- A.
0,5
- B.
1
- C.
2
- D.
3
- E.
4
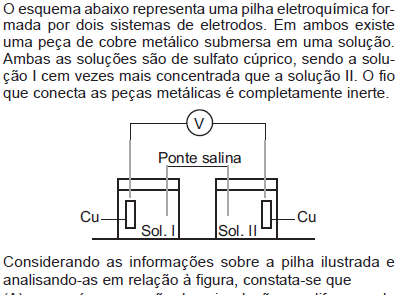
- A. ocorrerá uma reação de oxirredução e a diferença de potencial pode ser calculada a partir da equação de Nernst.
- B. ocorrerá uma reação de oxirredução, e a peça de cobre que está em contato com a solução I sofrerá oxidação.
- C. ocorrerá uma reação de oxirredução; porém, não é possível, a partir das informações fornecidas, estimar qual das peças sofrerá oxidação.
- D. não ocorrerá nenhuma reação, pois as peças metálicas em contato são da mesma natureza.
- E. não ocorrerá nenhuma reação, pois as peças de cobre metálico estão em contato com íons do próprio metal.


