Questões de Química da Centro de Seleção e de Promoção de Eventos UnB (CESPE)
Lista completa de Questões de Química da Centro de Seleção e de Promoção de Eventos UnB (CESPE) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Considerando que a faixa de viragem de pH para o vermelho de metila é de 4,4 a 6,2 e, para o vermelho de cresol, de 1,2 a 2,8, assinale a opção que apresenta ação que gera apenas erros indeterminados de análise.
- A.
Em uma análise volumétrica em que o vermelho de cresol seria o indicador de escolha, utiliza-se vermelho de metila.
- B.
Em uma análise gravimétrica de Fe(III), usa-se ácido clorídrico que contém impurezas de ferro.
- C.
Durante um processo de síntese, pesa-se um cadinho imediatamente após este ter sido retirado de uma estufa a 150 ºC.
- D.
Manuseia-se uma pipeta de forma distinta durante testes em triplicata.
A legislação brasileira determina que, para dirigir com segurança, os condutores de veículos não podem beber a ponto de apresentar no sangue concentração de álcool etílico superior a 0,6 g/L. Em média, o volume de sangue de um adulto é de 5 litros e, ao ingerir bebidas alcoólicas, o álcool passa rapidamente para a corrente sanguínea. Considerando que um motorista tenha ingerido 100 mL de licor de cacau, que apresenta um teor alcoólico de 27% em volume, e que a densidade do álcool seja de 0,78 g/cm3, julgue os itens a seguir.
Supondo que todo o álcool ingerido passou para o sangue, e considerando a quantidade em volume de sangue de um adulto, é correto afirmar que, imediatamente após a ingestão do licor, o motorista pode dirigir com segurança.- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
A equação a seguir representa a oxidação da magnetita (Fe3 O4 ) em hematita (Fe2 O3 ). 2 Fe3 O4 (s) + ½ O2 (g) 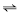 3 Fe2 O3 (s)
3 Fe2 O3 (s) 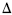 Hº f = -235,8 kJ/mol Considere-se que a reação acima se processe, em equilíbrio, em um sistema fechado à temperatura de 298 K e pressão de 1 atm. Nessa situação, caso o volume do recipiente onde se encontram as substâncias reagentes, sob condições isotérmicas, diminua, é correto afirmar que
Hº f = -235,8 kJ/mol Considere-se que a reação acima se processe, em equilíbrio, em um sistema fechado à temperatura de 298 K e pressão de 1 atm. Nessa situação, caso o volume do recipiente onde se encontram as substâncias reagentes, sob condições isotérmicas, diminua, é correto afirmar que
- A.
haverá mais hematita após o restabelecimento do equilíbrio.
- B.
haverá mais magnetita após o restabelecimento do equilíbrio.
- C.
o
 G será maior que zero para o processo de restabelecimento do equilíbrio.
G será maior que zero para o processo de restabelecimento do equilíbrio. - D.
a constante de equilíbrio da reação decrescerá.
A legislação brasileira determina que, para dirigir com segurança, os condutores de veículos não podem beber a ponto de apresentar no sangue concentração de álcool etílico superior a 0,6 g/L. Em média, o volume de sangue de um adulto é de 5 litros e, ao ingerir bebidas alcoólicas, o álcool passa rapidamente para a corrente sanguínea. Considerando que um motorista tenha ingerido 100 mL de licor de cacau, que apresenta um teor alcoólico de 27% em volume, e que a densidade do álcool seja de 0,78 g/cm3, julgue os itens a seguir.
O referido motorista ingeriu mais de 20 g de álcool.- C. Certo
- E. Errado
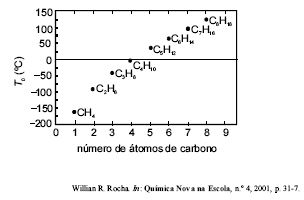
Considerando a figura acima, que mostra a variação da temperatura de ebulição de vários hidrocarbonetos lineares em função do número de átomos de carbono em suas moléculas, assinale a opção que apresenta uma explicação correta para as diferenças nas temperaturas de ebulição dessas substâncias.
- A.
Uma elevação da massa molar das substâncias provoca diminuição na temperatura de ebulição
- B.
As forças eletrostáticas associadas com as interações entre as moléculas representadas no gráfico são descritas matematicamente pela Lei de Coulomb.
- C.
Quanto maior o comprimento da ligação covalente, maior o ponto de ebulição da molécula que a contém.
- D.
Para compostos apolares, as polarizabilidades das duas moléculas em contato determinam a força de tal interação, visto que uma molécula afeta a densidade eletrônica da outra, e essa força de interação, por sua vez, determina a temperatura de ebulição.
Centenas de compostos voláteis foram identificados no café torrado e processado. Algumas substâncias identificadas são consideradas de impacto no aroma final do café, entre elas, incluem-se: metoxi-etano; metilpropanol; 3-metilbutanol; orto, meta e para-hidroxitolueno; etanotiol e dissulfeto de dimetila. Considerando essas informações, julgue os itens seguintes.
Os três isômeros do C7H8O diferem entre si pela posição do grupo OH.
- C. Certo
- E. Errado
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
A sacarose, composta por uma molécula de 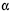 -D-glicose e uma de
-D-glicose e uma de 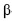 -D-frutose, tendo os átomos de carbono C1 da glicose e C2 da frutose participação na ligação glicosídica, é comumente conhecida como açúcar, sendo extraída para distribuição comercial da cana-de-açúcar (Sacharum officinarum) e da beterraba (Beta vulgaris). No estômago de mamíferos, a sacarose é digerida por hidrólise ácida, que é o mesmo processo usado, em laboratório, para se obterem glicose e frutose. Estas, resultantes da hidrólise da sacarose, são rapidamente absorvidas no intestino delgado, penetrando na corrente sanguínea. Por esses motivos, a sacarose é uma fonte de energia química rápida (com um conteúdo calórico de 17 kJ/g) e causa, logo após sua ingestão, a subida dos níveis sanguíneos de glicose. A partir do gráfico a seguir (ln k × 1/T), em que k representa a constante de velocidade da reação e T, a temperatura absoluta, é possível determinar um dos parâmetros de Arrhenius, isto é, a energia de ativação, Ea , para a hidrólise ácida da sacarose. Considere-se que a velocidade da reação dependa exclusivamente da concentração de sacarose e observe-se que dois pontos da reta são mostrados no gráfico.
-D-frutose, tendo os átomos de carbono C1 da glicose e C2 da frutose participação na ligação glicosídica, é comumente conhecida como açúcar, sendo extraída para distribuição comercial da cana-de-açúcar (Sacharum officinarum) e da beterraba (Beta vulgaris). No estômago de mamíferos, a sacarose é digerida por hidrólise ácida, que é o mesmo processo usado, em laboratório, para se obterem glicose e frutose. Estas, resultantes da hidrólise da sacarose, são rapidamente absorvidas no intestino delgado, penetrando na corrente sanguínea. Por esses motivos, a sacarose é uma fonte de energia química rápida (com um conteúdo calórico de 17 kJ/g) e causa, logo após sua ingestão, a subida dos níveis sanguíneos de glicose. A partir do gráfico a seguir (ln k × 1/T), em que k representa a constante de velocidade da reação e T, a temperatura absoluta, é possível determinar um dos parâmetros de Arrhenius, isto é, a energia de ativação, Ea , para a hidrólise ácida da sacarose. Considere-se que a velocidade da reação dependa exclusivamente da concentração de sacarose e observe-se que dois pontos da reta são mostrados no gráfico.
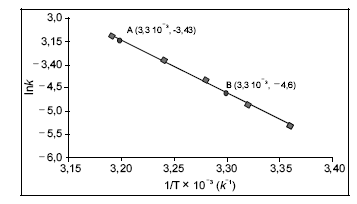
Considerando-se que a constante universal dos gases vale 8,3145 J·K-1· mol-1 , é correto concluir que o valor da energia de ativação da hidrólise ácida da sacarose é
- A.
inferior a 80 kJ/mol.
- B.
superior ou igual a 80 kJ/mol e inferior a 90 kJ/mol.
- C.
superior ou igual a 90 kJ/mol e inferior a 100 kJ/mol.
- D.
superior 100 kJ/mol.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Centenas de compostos voláteis foram identificados no café torrado e processado. Algumas substâncias identificadas são consideradas de impacto no aroma final do café, entre elas, incluem-se: metoxi-etano; metilpropanol; 3-metilbutanol; orto, meta e para-hidroxitolueno; etanotiol e dissulfeto de dimetila. Considerando essas informações, julgue os itens seguintes.
O hidroxitolueno pertence à função álcool.
- C. Certo
- E. Errado
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
No método de titulação, a solução cuja concentração é conhecida, chama-se solução-padrão. Para que uma substância seja considerada um padrão primário, ela deve atender a alguns requisitos necessários e outros desejáveis. É condição sine qua non, por exemplo, que a substância tenha alta pureza. Entre as condições desejáveis, está a de que ela deve ter elevada massa molar. Assinale a opção em se justifica a necessidade de o padrão primário atender a esse critério desejável.
- A.
Substâncias de elevada massa molar são geralmente de fácil purificação.
- B.
Substâncias de elevada massa molar reagem em uma proporção estequiométrica.
- C.
Substâncias de elevada massa molar minimizam erros de pesagem.
- D.
Tais substâncias são, em geral, higroscópicas.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Centenas de compostos voláteis foram identificados no café torrado e processado. Algumas substâncias identificadas são consideradas de impacto no aroma final do café, entre elas, incluem-se: metoxi-etano; metilpropanol; 3-metilbutanol; orto, meta e para-hidroxitolueno; etanotiol e dissulfeto de dimetila. Considerando essas informações, julgue os itens seguintes.
O éter citado apresenta a fórmula estrutural H3COC2H5.
- C. Certo
- E. Errado


