Questões de Química da Centro de Seleção e de Promoção de Eventos UnB (CESPE)
Lista completa de Questões de Química da Centro de Seleção e de Promoção de Eventos UnB (CESPE) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013

- A.
140,0.
- B.
175,0.
- C.
280,0.
- D.
310,3.
- E.
840,0.
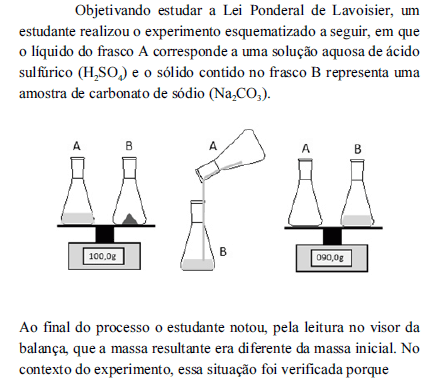
- A.
houve excesso de um dos reagentes empregados, o que não é previsto pela Lei de Lavoisier.
- B.
é necessário que o sistema seja fechado, o que não ocorreu no experimento realizado pelo estudante.
- C.
os reagentes devem se encontrar na mesma fase de agregação, o que não ocorreu no experimento realizado pelo estudante.
- D.
a Lei de Lavoisier não é válida para reações efetuadas em soluções aquosas.
- E.
a Lei de Lavoisier só é válida nas condições padrão de temperatura e pressão.

- A.

- B.

- C.

- D.

- E.

Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
Ao longo do tempo, o conceito de elemento químico se modificou. Desse modo, atualmente, define-se elemento químico como
- A.
uma substância simples, fundamental e elementar.
- B.
um tipo de átomo caracterizado por um número de massa específico.
- C.
uma substância que não pode ser decomposta em outras mais simples.
- D.
um grupo de átomos ou íons isoeletrônicos.
- E.
um conjunto de átomos e íons isótopos entre si.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
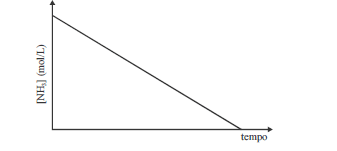
O processo de Haber-Bosh, que opera em altas temperaturas e altas pressões, é bastante utilizado para a produção industrial da amônia (NH3). Nesse processo, os gases nitrogênio (N2) e hidrogênio (H2) reagem exotérmica e reversivelmente para formar amônia gasosa (NH3). No processo inverso, a reação de decomposição da amônia em nitrogênio e hidrogênio em superfície de platina apresenta cinética que segue comportamento conforme representado no gráfico acima, que mostra a variação da concentração molar da amônia gasosa [NH3] em função do tempo. Acerca dessas reações, julgue os itens a seguir.

- C. Certo
- E. Errado
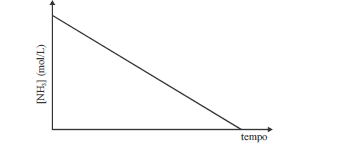
O processo de Haber-Bosh, que opera em altas temperaturas e altas pressões, é bastante utilizado para a produção industrial da amônia (NH3). Nesse processo, os gases nitrogênio (N2) e hidrogênio (H2) reagem exotérmica e reversivelmente para formar amônia gasosa (NH3). No processo inverso, a reação de decomposição da amônia em nitrogênio e hidrogênio em superfície de platina apresenta cinética que segue comportamento conforme representado no gráfico acima, que mostra a variação da concentração molar da amônia gasosa [NH3] em função do tempo. Acerca dessas reações, julgue os itens a seguir.
A partir do gráfico, é correto concluir que a reação envolvida é de ordem zero e que o módulo do valor da inclinação da reta representa a constante de velocidade da reação de consumo da amônia.- C. Certo
- E. Errado
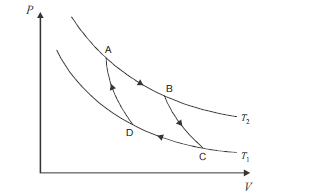
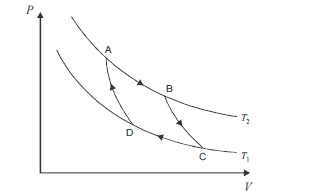
No ciclo de Carnot, ilustrado acima, no gráfico de pressão (P) versus volume (V), ocorrem processos reversíveis que passam pelos estados A, B, C e D. Considerando que as curvas do gráfico apresentam o comportamento de um gás ideal em um sistema fechado, que os processos BC e DA são adiabáticos e que AB e CD são isotérmicos, ocorrendo nas temperaturas T2 e T1, respectivamente, julgue os itens subsequentes.
Nas condições especificadas, se T1 for menor do que T2, o rendimento desse ciclo será de 100%.- C. Certo
- E. Errado
No ciclo de Carnot, ilustrado acima, no gráfico de pressão (P) versus volume (V), ocorrem processos reversíveis que passam pelos estados A, B, C e D. Considerando que as curvas do gráfico apresentam o comportamento de um gás ideal em um sistema fechado, que os processos BC e DA são adiabáticos e que AB e CD são isotérmicos, ocorrendo nas temperaturas T2 e T1, respectivamente, julgue os itens subsequentes.
O trabalho e o calor não são funções de estado, diferentemente da energia interna, que depende somente do estado em que se encontra o sistema.- C. Certo
- E. Errado
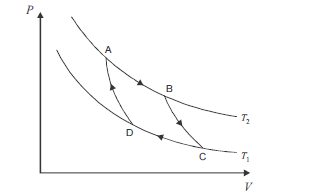
No ciclo de Carnot, ilustrado acima, no gráfico de pressão (P) versus volume (V), ocorrem processos reversíveis que passam pelos estados A, B, C e D. Considerando que as curvas do gráfico apresentam o comportamento de um gás ideal em um sistema fechado, que os processos BC e DA são adiabáticos e que AB e CD são isotérmicos, ocorrendo nas temperaturas T2 e T1, respectivamente, julgue os itens subsequentes.
A variação da entropia para o sistema e suas vizinhanças, após o gás percorrer o ciclo acima e retornar ao estado inicial A, é nula.- C. Certo
- E. Errado
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
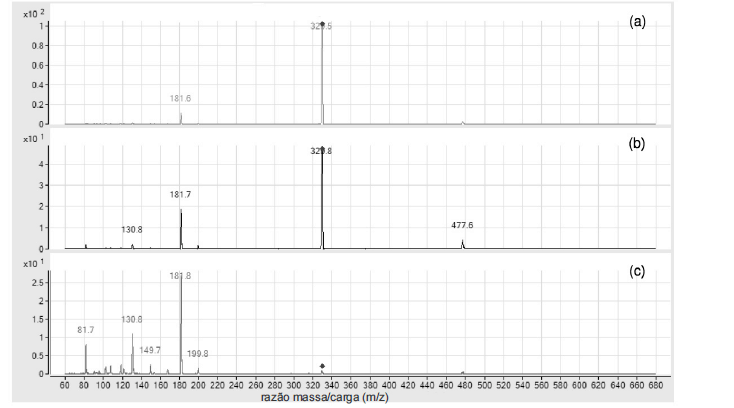
Considerando os gráficos acima, que representam espectros de massas de fragmentação (EM/EM) de um íon com m/z = 330,0 de uma truxilina, obtidos com três diferentes energias de colisão collision-induced dissociation (CID): (a) CID = 5, (b) CID = 10 e (c) CID = 20, julgue os itens de 102 a 109, relativos à espectrometria de massas.
Excluindo-se as possibilidades de infusão direta, os espectros mostrados só poderiam ser obtidos por acoplamento com a cromatografia gasosa (CG-EM/EM), pois a cromatografia líquida é incompatível com a espectrometria de massas.- C. Certo
- E. Errado


