Questões de Química da Centro de Seleção e de Promoção de Eventos UnB (CESPE)
Lista completa de Questões de Química da Centro de Seleção e de Promoção de Eventos UnB (CESPE) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.

- A.
ð3 < ð1 < ð2.
- B.
ð2 < ð1 < ð3.
- C.
ð1 < ð3 < ð2.
- D.
ð1 < ð2 < ð3.
- E.
ð3 < ð2 < ð1.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
Considere que, para preparar, por diluição, uma cerveja considerada não alcoólica, de concentração 0,5°GL, disponha-se de uma amostra de 600 mL de uma cerveja com 5,5° GL. Nessa situação, é correto afirmar que o volume mínimo obtido nessa preparação será superior a
- A.
4,5 L.
- B.
0,1 L.
- C.
1,6 L.
- D.
3,3 L.
- E.
6,6 L.
Os metais apresentam muitas propriedades distintivas, que os tornam materiais de grande funcionalidade em nosso cotidiano. Isso decorre da ligação metálica, que, de acordo com a teoria do mar de elétrons, caracteriza-se pela presença de elétrons
- A.
transferidos de forma definitiva entre átomos da estrutura cristalina.
- B.
deslocalizados compartilhados entre os átomos da estrutura cristalina.
- C.
transferidos entre cátions e ânions da estrutura cristalina.
- D.
localizados compartilhados entre os átomos da estrutura cristalina.
- E.
excitados na camada de valência dos átomos da estrutura cristalina.
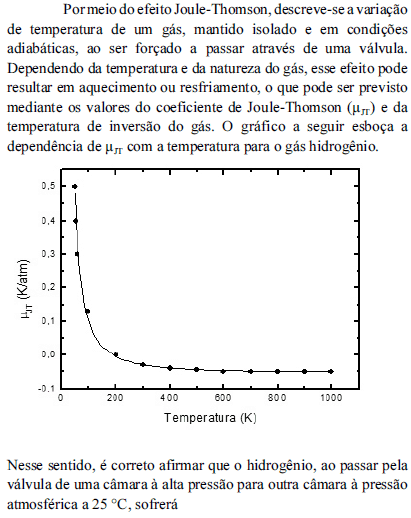
- A.
resfriamento por estar a uma temperatura igual a de inversão.
- B.
aquecimento por estar a uma temperatura superior a de inversão.
- C.
aquecimento por estar a uma temperatura inferior a de inversão.
- D.
resfriamento por estar a uma temperatura superior a de inversão.
- E.
resfriamento por estar a uma temperatura inferior a de inversão.

- A.
da descontinuidade da matéria.
- B.
da natureza elétrica da matéria.
- C.
da indivisibilidade da matéria.
- D.
da presença de antimatéria no universo.
- E.
da característica dualísta da matéria.
A descrição da estrutura eletrônica em sistemas moleculares é, geralmente, realizada por modelos. Um dos mais utilizados para esse fim é a teoria da ligação de valência (TLV), uma extensão da teoria de Lewis, que considera alguns princípios da mecânica quântica. No entanto, por serem modelos, muitas vezes apresentam resultados distintos daqueles observados experimentalmente. No caso do oxigênio molecular (O2), a TLV é
- A.
adequada para descrever sua estrutura eletrônica, pois confirma o paramagnetismo da molécula.
- B.
inadequada para descrever sua estrutura eletrônica, pois não prevê o diamagnetismo da molécula.
- C.
adequada para descrever sua estrutura eletrônica, pois confirma o diamagnetismo da molécula.
- D.
inadequada para descrever sua estrutura eletrônica, pois não prevê o paramagnetismo da molécula.
- E.
adequada para descrever sua estrutura eletrônica, pois não prevê o paramagnetismo da molécula.

- A.
14
- B.
4
- C.
5
- D.
8
- E.
11

- A.
KBr, AlCl3 e AsF3
- B.
LiBr, AlCl3 e AsF3
- C.
KBr, PCl3 e NF3
- D.
LiBr, PCl3 e AsF3
- E.
LiBr, PCl3 e NF3
Entre os compostos fluorados de enxofre que são relevantes para a indústria constam os gases sintéticos tetrafluoreto de enxofre (SF4) e hexafluoreto de enxofre (SF6). Apesar de serem formados pelos mesmos elementos, esses gases apresentam reatividade química contrastante, pois o tetrafluoreto é muito reativo e o hexafluoreto é extraordinariamente inerte. Esse fato decorre principalmente da geometria molecular que, no caso do SF4, é do tipo
- A.
quadrado planar.
- B.
pirâmide tetragonal.
- C.
gangorra.
- D.
octaédrica.
- E.
tetraédrica.
Nos séculos XVIII e XIX, apesar do grande interesse pelos fenômenos elétricos, a natureza da eletricidade não estava esclarecida. Nesse sentido, etapas importantes foram dadas pelo cientista inglês Michael Faraday, que, por meio de seus experimentos de eletrólise, introduziu a nomenclatura para designar os polos opostos presentes no sistema eletrolítico (ânodo e cátodo) e estabeleceu o grau de afinidade química de dois elementos. Desse modo, a maior contribuição desse cientista relativa à natureza elétrica da matéria foi
- A.
estabelecer a terapêutica baseada na eletricidade ou eletricidade médica.
- B.
propor o sistema dualístico, segundo o qual átomos com mesmo tipo de carga elétrica não poderiam se combinar.
- C.
enunciar as leis da estequiometria eletroquímica, provendo a correspondência quantitativa entre ação elétrica e eventos químicos.
- D.
fabricar a primeira pilha elétrica.
- E.
inventar a primeira máquina a produzir eletricidade.


