Questões de Química da Fundação Carlos Chagas (FCC)
Lista completa de Questões de Química da Fundação Carlos Chagas (FCC) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
A neutralização de uma solução ácida pode ser realizada pela adição de materiais com propriedades alcalinas, como
- A.
sal de cozinha e detergente.
- B.
sal de cozinha e vinagre.
- C.
fermento químico e amoníaco.
- D.
detergente e vinagre.
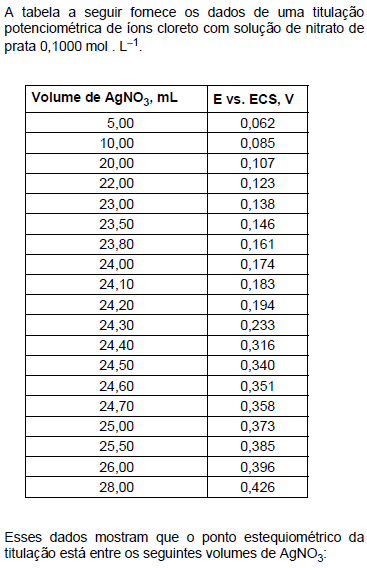
- A.
24,20 mL e 24,30 mL.
- B.
24,30 mL e 24,40 mL.
- C.
24,50 mL e 24,60 mL.
- D.
24,60 mL e 24,70 mL.
- E.
24,70 mL e 25,00 mL.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação Carlos Chagas (FCC) - 2012
O isótopo carbono-14 é radiativo e utilizado para a determinação da idade de fósseis. A meia vida desse elemento é de cerca de 5.000 anos. Um esqueleto que apresenta 25% desse elemento em relação ao normal deve ter morrido há, aproximadamente,
- A.
2.500 anos.
- B.
5.000 anos.
- C.
10.000 anos.
- D.
20.000 anos.
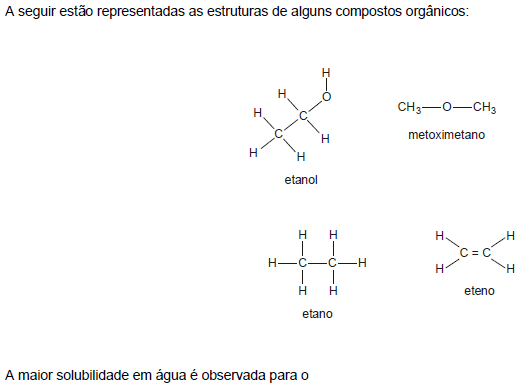
- A.
etanol.
- B.
metoximetano.
- C.
etano.
- D.
eteno.
Para medidas de pH por potenciometria utiliza-se o eletrodo indicador
- A.
de vidro.
- B.
de calomelano.
- C.
metálico inerte.
- D.
de prata/cloreto de prata.
- E.
metálico de primeiro tipo.
Átomos de mesmo elemento que ganham estabilidade ao perder elétrons tendem a se unir entre si por ligação
- A.
metálica, devido à transferência dos elétrons de um átomo para outro.
- B.
covalente, devido à transferência dos elétrons de um átomo para outro.
- C.
iônica, devido à transferência dos elétrons de um átomo para outro.
- D.
metálica, devido à atração do núcleo de um átomo pela eletrosfera dos átomos vizinhos.
Na titulação de 20,00 mL de uma solução de H3PO4 foram gastos 26,50 mL de solução 5,00 × 10−2 mol . L−1 de NaOH. A concentração, em mol . L−1, da solução de H3PO4 é igual a
- A.
2,21 × 10−2
- B.
1,12 × 10−2
- C.
2,00 × 10−1
- D.
3,56 × 10−1
- E.
5,32 × 10−1
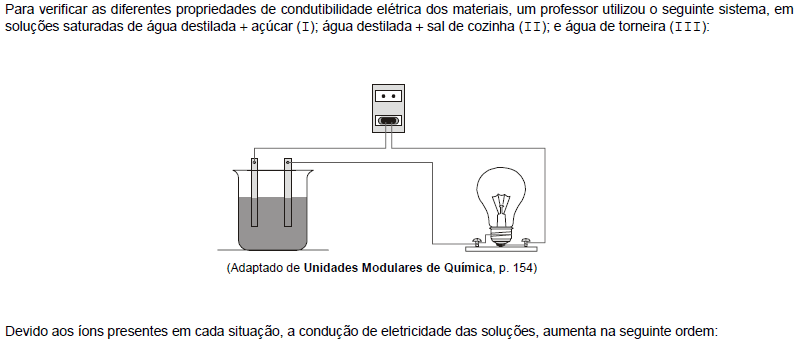
- A.
II, III e I.
- B.
II, I e III.
- C.
I, III e II.
- D.
III, II e I.
Considere a seguinte equação NÃO balanceada para a oxidação de nitrito:
MnO4 − + H+ + NO2 − → Mn2+ + NO3 − + H2O
Completam corretamente essa equação, os seguintes coeficientes estequiométricos, respectivamente:
- A.
1, 3, 2, 1, 2, 1
- B.
1, 3, 4, 1, 4, 2
- C.
2, 4, 6, 2, 6, 1
- D.
2, 5, 2, 2, 5, 2
- E.
2, 6, 5, 2, 5, 3
A sacarose, ou açúcar comum, se dissolve facilmente em água porque
- A.
as ligações covalentes da estrutura desse açúcar são rompidas pela água.
- B.
os grupos OH desse açúcar formam ligações de hidrogênio com a água.
- C.
os íons desse açúcar ficam dispersos na água.
- D.
esse açúcar e a água são estruturas apolares.


