Questões de Química da Fundação Carlos Chagas (FCC)
Lista completa de Questões de Química da Fundação Carlos Chagas (FCC) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Na determinação de nitrogênio amoniacal, em uma amostra, foram realizados procedimentos envolvendo as seguintes reações:
H2PtCl6 (aq) + 2NH4 + (aq) → (NH4)2PtCl6 (s) + 2H+ (aq)
(NH4)2PtCl6 (s) → Pt (s) + 2Cl2 (g) + 2NH3 (g) + 2HCl (g)
Ao se formar 0,6378 g de Pt (s), conclui-se que foi determinada uma quantidade de amônio, na amostra, em mol, de, aproximadamente,
Dados:
Massas molares (g/mol):
H = 1,0
N = 14,0
Pt = 195,1
Cl = 35,5
- A.
1,2 × 10−3
- B.
3,4 × 10−3
- C.
6,5 × 10−3
- D.
7,3 × 10−3
- E.
9,1 × 10−3
Uma reação com catalisador é mais rápida em relação à mesma reação sem catalisador porque
- A.
a energia de ativação da etapa mais lenta é menor.
- B.
o caminho da reação é menor.
- C.
o complexo ativado se forma em etapas exotérmicas.
- D.
a reação de endotérmica passa a ser exotérmica.
Uma amostra de massa igual a 0,5742 g contendo 78,12% (em massa) de MgCO3 foi calcinada em temperatura adequada. A massa, em gramas, de CO2 (g) liberada, considerando que todo o MgCO3 foi convertido em MgO, é igual a
Dados:
Massas molares (g/mol):
C = 12,0
O = 16,0
Mg = 24,0
- A.
0,0214
- B.
0,0845
- C.
0,1173
- D.
0,1988
- E.
0,2350

- A.
o zinco metálico sofra oxidação.
- B.
a tensão elétrica da célula galvânica formada seja 5,34 V.
- C.
o eletrodo de lítio seja o cátodo da célula galvânica.
- D.
os elétrons fluam do Li (s) para o Zn (s).

- A.
azul de timol (faixa de transição de pH: 1,2 − 2,8).
- B.
alaranjado de metila (faixa de transição de pH: 2,9 − 4,6).
- C.
verde de bromocresol (faixa de transição de pH: 3,6 − 5,2).
- D.
fenolftaleína (faixa de transição de pH: 8,3 − 10,0).
- E.
amarelo de alizarina (faixa de transição de pH: 10 − 12).
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação Carlos Chagas (FCC) - 2012
Considere um composto do tipo MX, onde M é um metal alcalino e X é um halogênio, pertencentes ao 2º período da Tabela Periódica. Esse composto
- A.
é molecular e não conduz corrente elétrica no estado líquido.
- B.
apresenta temperatura de fusão e de ebulição menores do que a água.
- C.
é iônico e bom condutor de eletricidade no estado líquido.
- D.
é formado por moléculas e existem forças covalentes bastante intensas entre seus átomos.
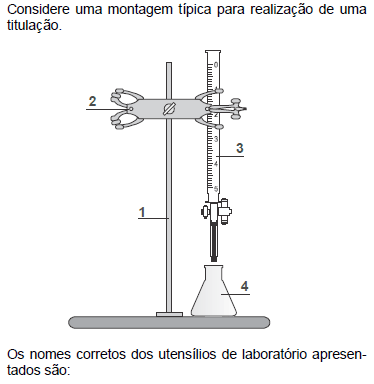
- A.
1. suporte universal; 2. pinça; 3. pipeta graduada; 4. béquer.
- B.
1. suporte universal; 2. pinça; 3. bureta; 4. erlenmeyer.
- C.
1. suporte universal; 2. pinça; 3. pipeta graduada; 4. erlenmeyer.
- D.
1. garra; 2. suporte universal; 3. bureta; 4. béquer.
- E.
1. garra; 2. tripé; 3. pipeta graduada; 4. béquer.
O iodo é um sólido cristalino, cinza, brilhante. No aquecimento de seus cristais, origina-se um gás violeta. A mudança de estado físico descrita para o iodo é
- A.
vaporização.
- B.
sublimação.
- C.
condensação.
- D.
fusão.
A padronização de uma alíquota de 25,0 mL de solução de NaOH consumiu 3,234 g de biftalato de potássio, KHC8H4O4. A concentração, em mol . L−1, da solução padronizada de NaOH corresponde a
Dado:
Massa molar (g . mol−1):
biftalato de potássio = 204
- A.
0,016
- B.
0,335
- C.
0,634
- D.
0,864
- E.
1,554
Um litro de solução de ácido perclórico, HClO4, de pH = 2,0, foi diluído com água até o dobro do volume inicial. O pH da nova solução
Dados:
log 5 = 0,7
log 2 = 0,3
- A.
aumentou em uma unidade de pH.
- B.
diminuiu em 0,7 unidade de pH.
- C.
diminuiu em 0,5 unidade de pH.
- D.
aumentou em 0,3 unidade de pH.


