Questões de Química da Núcleo de Computação Eletrônica UFRJ (NCE)
Lista completa de Questões de Química da Núcleo de Computação Eletrônica UFRJ (NCE) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Dentre as matérias-primas utilizadas na produção de ferro-gusa destaca-se o coque metalúrgico. Este é o resíduo sólido originado do seguinte processo:
- A.
queima do carvão mineral;
- B.
gaseificação da madeira;
- C.
condensação da matéria-volátil da turfa;
- D.
destilação, na ausência de oxigênio, do carvão mineral de grau metalúrgico;
- E.
combustão do carvão vegetal pulverizado.
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
A flotação é uma operação de concentração mineral que explora as propriedades de interface dos minerais. A adequada adição e adsorção de reagentes químicos como coletores, depressores, ativadores e espumantes numa célula de flotação conduz para:
- A.
separação seletiva dos minerais com caráter hidrofóbico dos minerais com caráter hidrofílico;
- B.
perda de seletividade mineral;
- C.
impedimento da separação do mineral de interesse em relação aos minerais da fase ganga;
- D.
formação de diversas frações granulométricas;
- E.
formação de um conjunto de minerais silicatados.
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
A concentração gravimétrica é fundamentalmente baseada na relação de queda livre ou impedida entre dois minerais, destacando-se a:
- A.
diferença de forma das partículas do mineral de interesse e dos minerais formadores da fase ganga;
- B.
diferença significativa entre a densidade do mineral de interesse e dos minerais da fase ganga;
- C.
susceptibilidade magnética dos minerais que constituem o minério;
- D.
forma das partículas minerais não liberadas;
- E.
cominuição seletiva de um minério.
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
A cominuição consiste na redução gradual do tamanho de um minério proveniente de uma mina e controle na produção de frações granulométricas do mesmo, podendo levar à liberação de um mineral de interesse do minério. Esta liberação consiste em:
- A.
gerar uma assembléia de partículas com tamanhos diferentes;
- B.
gerar uma assembléia de partículas contendo cada uma delas, predominantemente, uma fase mineral;
- C.
separar o mineral de interesse dos minerais que compõem a ganga;
- D.
reduzir o tamanho das partículas de um minério;
- E.
gerar uma assembléia mineral contendo partículas de diversos tamanhos e formas.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
O Brasil possui reconhecidas jazidas minerais portadoras de diversos minérios contendo óxidos, sulfetos e silicatos. Neste contexto, o minério itabirítico é essencialmente constituído dos seguintes minerais:
- A.
óxidos de cobre e pirita;
- B.
covelita e pirita;
- C.
óxidos de ferro e quartzo;
- D.
carbonato duplo de cálcio e magnésio e quartzo;
- E. silicatos de ferro e magnésio.

- A.
0;
- B.
3,2;
- C.
0,6;
- D.
1,8;
- E.
0,8.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
Os pontos de fusão e de ebulição das aminas são determinados pelas intensidades de suas interações intermoleculares. A tabela a seguir mostra as fórmulas bastão de três aminas com mesmo número de átomos de carbono:
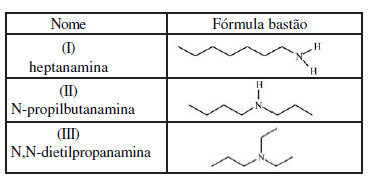
A ordem dos pontos de ebulição dessas aminas é:
- A.
I > II > III;
- B.
III > II > I;
- C.
II > III > I;
- D.
I > III > II;
- E.
I < II < III.
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
A ionização do H2SO4 em água produz as seguintes reações de equilíbrio:
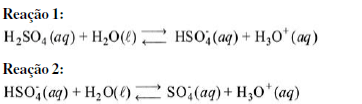
Segundo a teoria de ácidos e bases de Brönsted-Lowry, as espécies a seguir podem ser definidas como:
- A.
HSO4 − como ácido na Reação 1 e na Reação 2;
- B.
H2O como ácido Reação 1 e como base na Reação 2;
- C.
H3O+ como ácido Reação 1 e como base na Reação 2;
- D.
HSO4 − como base na Reação 1 e como ácido na Reação 2;
- E.
H2SO4 como ácido Reação 1 e H3O+ como base na Reação 2.
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
Um dos riscos da utilização do hidrogênio como combustível veicular é sua liberação acidental, pois a reação entre o hidrogênio gasoso e o oxigênio atmosférico é uma reação explosiva:

- A.
2 g e 32 g;
- B.
4 g e 16 g;
- C.
5 g e 80 g;
- D.
10 g e 320 g;
- E.
20 g e 160 g.
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
A reação de esterificação entre o 1-propanol e o ácido etanóico produz:
- A.

- B.

- C.

- D.

- E.



