Questões de Engenharia Química
Lista completa de Questões de Engenharia Química para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
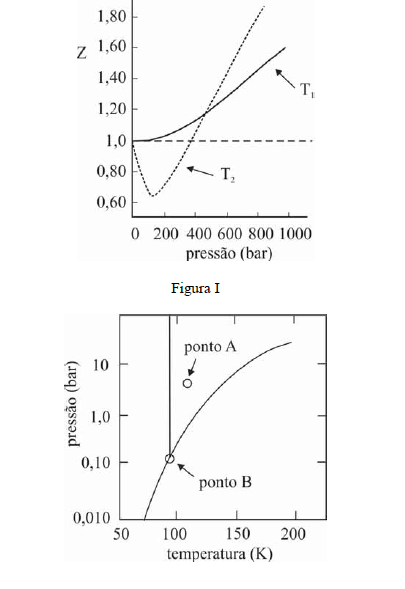
A figura I ilustra o gráfico do coeficiente de compressibilidade (Z) do CH4 (g) em função da pressão para duas temperaturas distintas (T1 e T2), e a figura II representa o diagrama de fases desse mesmo composto. A partir das figuras apresentadas, julgue os itens que se seguem.
Na temperatura T2, o CH4 (g), a 200 bar de pressão, ocupará um volume superior ao estimado pela equação dos gases ideais, o que demonstra que as forças atrativas predominam sobre as forças repulsivas.- C. Certo
- E. Errado
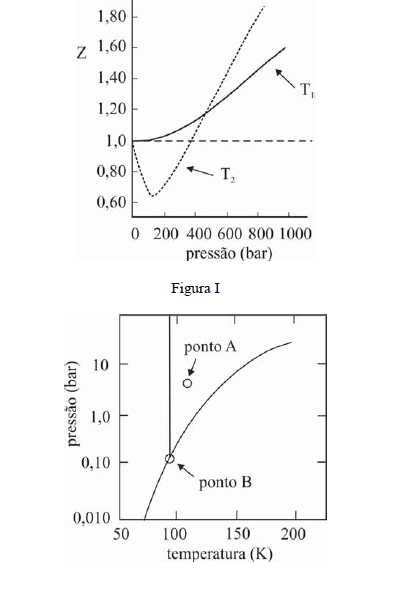
A figura I ilustra o gráfico do coeficiente de compressibilidade (Z) do CH4 (g) em função da pressão para duas temperaturas distintas (T1 e T2), e a figura II representa o diagrama de fases desse mesmo composto. A partir das figuras apresentadas, julgue os itens que se seguem.
Infere-se da situação mostrada na figura I que T1 é maior que T2.- C. Certo
- E. Errado
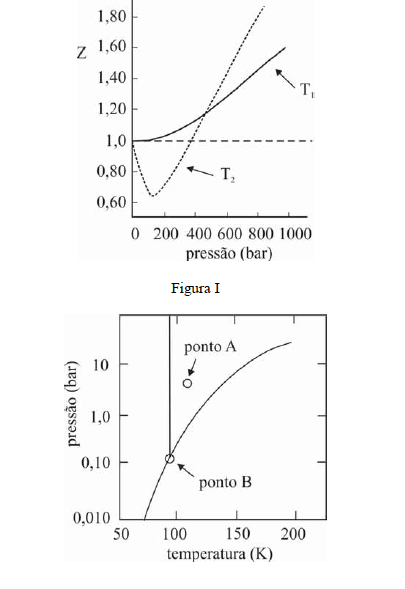
A figura I ilustra o gráfico do coeficiente de compressibilidade (Z) do CH4 (g) em função da pressão para duas temperaturas distintas (T1 e T2), e a figura II representa o diagrama de fases desse mesmo composto. A partir das figuras apresentadas, julgue os itens que se seguem.
O CH4 não pode ser liquefeito por simples compressão à temperatura de 150 K, uma vez que o ponto B, na figura II, corresponde à temperatura crítica desse gás.- C. Certo
- E. Errado
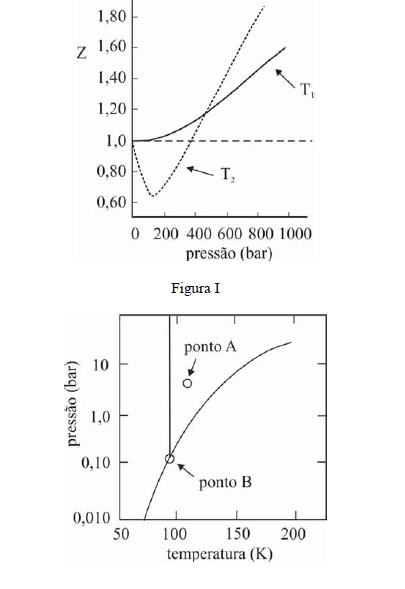
A figura I ilustra o gráfico do coeficiente de compressibilidade (Z) do CH4 (g) em função da pressão para duas temperaturas distintas (T1 e T2), e a figura II representa o diagrama de fases desse mesmo composto. A partir das figuras apresentadas, julgue os itens que se seguem.
Na temperatura e pressão correspondentes ao ponto A da figura II, o potencial químico do metano gasoso é superior ao do metano líquido.- C. Certo
- E. Errado
Uma célula eletroquímica realiza a eletrólise de uma solução aquosa de NaCl operando com uma corrente constante de 100,0 A e com rendimento de 100% para a formação de Cl2. Considerando que a massa molar do Cl2 seja igual a 70,9 g/mol e que a constante de Faraday seja igual a 96.500 C/mol, julgue os próximos itens. O tempo necessário para a formação de 709 g de Cl2, a partir da eletrólise da solução aquosa de NaCl, é superior a 2 h.
- C. Certo
- E. Errado
Uma célula eletroquímica realiza a eletrólise de uma solução aquosa de NaCl operando com uma corrente constante de 100,0 A e com rendimento de 100% para a formação de Cl2. Considerando que a massa molar do Cl2 seja igual a 70,9 g/mol e que a constante de Faraday seja igual a 96.500 C/mol, julgue os próximos itens. Na eletrólise da solução aquosa de NaCl, a formação do Cl2 ocorre no ânodo da célula.
- C. Certo
- E. Errado

Considerando que as reações de hidrogenação sejam exotérmicas, que todos os gases envolvidos apresentem comportamento ideal e que o produto da constante universal dos gases pela temperatura absoluta (R×T) seja igual a 2.500 J/mol, julgue os itens que se seguem.
A constante de equilíbrio para a reação de hidrogenação do C2H4 (g) a 100 ºC é maior que a 25 ºC.- C. Certo
- E. Errado

Considerando que as reações de hidrogenação sejam exotérmicas, que todos os gases envolvidos apresentem comportamento ideal e que o produto da constante universal dos gases pela temperatura absoluta (R×T) seja igual a 2.500 J/mol, julgue os itens que se seguem.
Sob determinada temperatura, a reação de hidrogenação do C2H4 (g) liberará maior quantidade de calor se realizada a volume constante, e não a pressão constante.- C. Certo
- E. Errado

Considerando que as reações de hidrogenação sejam exotérmicas, que todos os gases envolvidos apresentem comportamento ideal e que o produto da constante universal dos gases pela temperatura absoluta (R×T) seja igual a 2.500 J/mol, julgue os itens que se seguem.
A energia de ativação da reação de hidrogenação catalisada pelo metal B é superior à da reação catalisada pelo metal A.- C. Certo
- E. Errado

Considerando que as reações de hidrogenação sejam exotérmicas, que todos os gases envolvidos apresentem comportamento ideal e que o produto da constante universal dos gases pela temperatura absoluta (R×T) seja igual a 2.500 J/mol, julgue os itens que se seguem.
Considere que a reação de hidrogenação em apreço seja de ordem um com relação ao C2H4 (g) e de ordem um com relação ao H2 (g), e que as concentrações iniciais de cada um dos dois reagentes sejam iguais a x0. Nessas condições, a concentração de C2H4 em um instante t da reação é dada por x0/(1 + k.t.x0), em que k é a constante de velocidade na temperatura da reação.- C. Certo
- E. Errado


