Questões de Química
Lista completa de Questões de Química para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
A utlização do eletrodo de Ag/AgCl pode ser tanto como eletrodo de referência quanto como eletrodo indicador.
PORQUE
O eletrodo Ag/AgCl tem um potencial conhecido, que é essencialmente constante e insensível à composição das soluções de estudo, sendo, ainda, construído com base em uma reação reversível; obedece à Equação de Nerst, pode retornar ao seu potencial original após ser submetido a pequenas correntes e exibe baixa histerese sob ciclos de temperatura. A esse respeito, conclui-se que
- A.
as duas afirmações são verdadeiras, e a segunda justifica a primeira.
- B.
as duas afirmações são verdadeiras, e a segunda não justifica a primeira.
- C.
a primeira afirmação é verdadeira, e a segunda é falsa.
- D.
a primeira afirmação é falsa, e a segunda é verdadeira.
- E.
as duas afirmações são falsas.
A caracterização dos elétrons como parte da matéria se deu através dos tubos de raios catódicos, que consistiam em um tubo selado com um gás e eletrodos metálicos conectados aos polos de uma fonte.
Thomson é o mais famoso cientista dentre os que trabalharam com os tubos de raios catódicos. Sua experiência baseou-se na interação dos raios catódicos com campos magnético e elétrico conhecidos para determinar a razão carga/massa dessas partículas. Além dos raios catódicos, também foram observados os chamados raios canais, de carga positiva, que eram os íons dos gases presentes nas ampolas. Analise as afirmações a seguir sobre as experiências com tubos de raios catódicos e raios canais. I Os raios catódicos são atraídos por uma chapa metálica ligada ao polo positivo de uma bateria. II A mudança dos gases no interior dos tubos não afeta a razão carga/massa dos raios catódicos. III A razão carga/massa dos raios canais é dependente do gás presente no interior das ampolas. IV Ao inverter a ligação dos polos da fonte com os eletrodos das ampolas, os raios catódicos se transformam em prótons. Estão corretas APENAS as afirmativas- A. I e IV.
- B. II e IV.
- C. II e III.
- D. I, II e III.
- E. I, III e IV.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação CESGRANRIO (CESGRANRIO) - 2011
Em função de suas características físico-químicas, a água utilizada
- A.
em combate a princípio de incêndio, tem dificuldade de escorrer da superfície do líquido inflamável, facilitando sua penetração na massa líquida.
- B.
em jato compacto, é inadequada para combater o fogo em líquidos inflamáveis de baixo ponto de fulgor, derivados do petróleo.
- C.
com a velocidade de seu jato reduzida através da adição de componentes químicos, elimina o risco do fenômeno água rápida.
- D.
na forma de neblina, serve para combater incêndios de grandes proporções, em líquidos inflamáveis.
- E.
no combate a início de incêndio num motor elétrico de bomba de combustível, em funcionamento, deve estar em jato compacto.
Uma solução de uma dada amostra apresenta absortividade de 200 Lmol1cm1. Foi analisada por espectroscopia na região do UV/Vis em um comprimento de onda na qual se obedece à lei Lambert Beer na concentração empregada nesse experimento. Considere que o caminho óptico é de 1 mm, e a absorbância observada é 0,4. Empregando esse resultado na equação de Lambert-Beer, conclui-se que a concentração da amostra é, aproximadamente,
- A.
0,01 molL1
- B.
0,02 molL1
- C.
0,002 molL1
- D.
8,0 molL1
- E.
80 molL1

- A. 25 e 30
- B. 30 e 35
- C. 35 e 40
- D. 40 e 45
- E. 45 e 50
Ao se eliminar a presença do oxigênio num ambiente onde está ocorrendo um princípio de incêndio, proporciona-se a descontinuidade da existência do Triângulo do Fogo no local. A consequência desse fato é a(o)
- A.
extinção do fogo por abafamento.
- B.
queima somente do material orgânico no ambiente.
- C.
transformação do fogo em incêndio.
- D.
alastramento do fogo para onde haja mais combustível.
- E.
risco de explosão por insuficiência de comburente.
Para se determinar o teor de cloreto em 1 litro de uma solução salina pelo método de Volhard, retirou-se uma alíquota de 25 mL da mesma, que foi tratada com 40 mL de uma solução padrão de nitrato de prata com concentração 0,150 M. Após a precipitação quantitativa do cloreto na forma de AgCl, titulou-se o excesso de prata remanescente com uma solução padrão de KSCN 0,200 M, contendo íons Fe3+ como indicador. O volume de titulante gasto para se atingir o ponto de equivalência foi de 5 mL. Com base nesses dados, conclui-se que a massa de cloro presente na forma de cloreto na solução inicial é, aproximadamente, de
- A.
0,2 g
- B.
1,0 g
- C.
5,0 g
- D.
6,0 g
- E.
7,0 g
O seguinte procedimento foi realizado para se preparar uma solução de cloreto de cálcio:
I foram pesados 2,22 g de cloreto de cálcio; II a massa do sal foi dissolvida em 200 ml de água em um béquer; III transferiu-se o conteúdo do béquer para um cilindro graduado, onde se adicionou água até que o volume de solução fosse de 500 ml. Se 100 ml da solução de cloreto de cálcio foi misturada a 100 ml de uma solução aquosa de cloreto de sódio 5,85 g/L, a concentração de íons cloreto, em mol/L, na mistura, é de- A. 7,00 x 102
- B. 9,00 x 102
- C. 1,20 x 101
- D. 1,40 x 101
- E. 1,80 x 101
Os elementos constituintes do esquema didático conhecido como Triângulo do Fogo são
- A.
comburente, combustível e fonte de ignição.
- B.
combustível, fonte de ignição e energia de ativação.
- C.
energia de ativação, gases quentes e acetileno.
- D.
hidrogênio, fonte de ignição e combustível.
- E.
oxigênio, álcool e fonte de ignição.
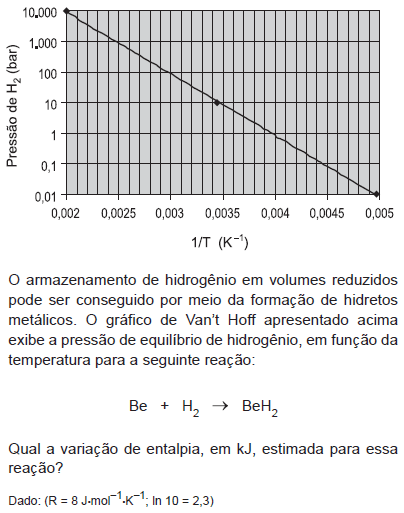
- A.
37
- B.
20
- C.
0
- D.
35
- E.
47


