Questões de Química
Lista completa de Questões de Química para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
A síntese da amônia a partir dos gases hidrogênio e nitrogênio era um dos grandes desafios da humanidade entre o final do século XIX e o início do século XX. O maior problema envolvido nessa reação era a baixa conversão em amônia, que inviabilizava a produção em escala industrial. O estudo do equilíbrio químico dessa reação envolveu diversos cientistas, sendo Fritz Haber o nome mais celebrado, por obter as condições reacionais como temperatura, pressão e catalisadores, que permitiram a produção de amônia em grande escala. Considere que, em um sistema fechado, tal processo atingiu o equilíbrio com pressão de 1,0 atm e temperatura de 450 K. Sabendo-se que essa é uma reação exotérmica, analise as afirmativas a seguir.
I É possível formar mais amônia com a pressão de 1,0 atm se a temperatura for menor que 450 K. II Na temperatura de 450 K e pressão de 1,0 atm, não há formação de amônia, porque o processo está em equilíbrio. III Com a pressão em 1,0 atm e a temperatura de 450 K, é possível formar mais amônia, utilizando um catalisador. IV Para formar mais amônia na temperatura de 450 K, é preciso que a pressão seja maior que 1,0 atm. São corretas APENAS as afirmativas- A. I e IV.
- B. II e III.
- C. III e IV.
- D. I, II e III.
- E. I, II e IV.
Com relação a incêndios, é correto afirmar-se que fogo é um(a)
- A.
resultado palpável de reação de oxidação que envolve contato físico entre combustível, fonte de ignição e gases devidamente aquecidos.
- B.
resultado visível de uma reação de combustão, na qual o comburente produz gases que se queimam, produzindo luz e calor.
- C.
aparência dos gases queimados numa reação entre o oxigênio e o comburente na presença de um combustível.
- D.
consequência da reação química de oxidação, conhecida como combustão, favorecida por uma energia de iniciação.
- E.
forma em que se apresenta o conteúdo energético de uma reação química entre o ar atmosférico e um combustível em qualquer de seus estados físicos.
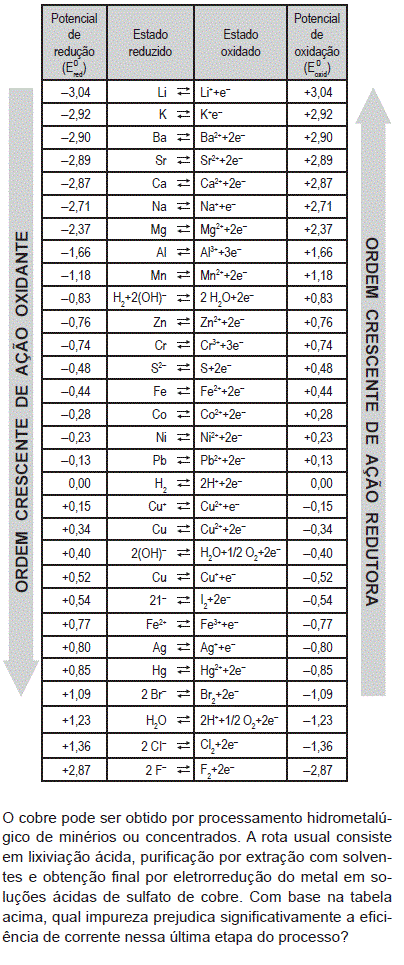
- A.
Mn
- B.
Cr
- C.
Co
- D.
Fe
- E.
F
As fórmulas químicas corretas do metasilicato de sódio, cromato de potássio, tiossulfato de sódio e tiocianato de sódio são, respectivamente,
- A. Na2SiO3 , K2CrO4 , Na2S2O3 e NaSCN
- B. Na2SiO4 , K2CrO4 , Na2S2O3 e NaNCS
- C. Na2SiO4 , K2Cr2O7 , Na2S2O7 e NaSCN
- D. Na2SiO3 , K2Cr2O7 , Na2S2O7 e NaNCS
- E. Na2Si2O3 , K2Cr2O7 , Na2S2O7 e NaSCN
Misturas de líquidos ou líquidos que contenham sólidos em solução ou suspensão, constituem os líquidos inflamáveis, substâncias que
- A.
produzem vapor inflamável até 65,0 ºC em ensaio de vaso fechado.
- B.
produzem vapor inflamável até 60,5 ºC em ensaio de vaso fechado.
- C.
apresentam ponto de fulgor até 67,6 ºC em ensaio de vaso aberto.
- D.
apresentam ponto de fulgor até 66,7 ºC em ensaio de vaso aberto.
- E.
apresentam ponto de ignição a 66,7 ºC em ensaio de vaso fechado.

- A.
20
- B.
32
- C.
40
- D.
64
- E.
100
Os compostos organoclorados são extremamente tóxicos e podem ser formados pela queima do polímero
- A. teflon.
- B. dracon.
- C. pet.
- D. pvc.
- E. nylon.
O gás carbônico é um agente expelido do extintor de incêndio na forma de gás. O dispositivo desse extintor com função de dirigir o jato de gás sobre o material que está queimando denomina-se
- A.
difusor
- B.
gatilho
- C.
ampola de gás
- D.
pino de segurança
- E.
válvula redutora de pressão
A combinação das Leis de Boyle, de Charles e de Avogadro gerou a Lei dos Gases Ideais, representada pela expressão PV = nRT. Essa é uma equação de estado que descreve a resposta de um gás ideal a mudanças de pressão, volume, temperatura e quantidade de moléculas. Entretanto, vários processos industriais e pesquisas em laboratório usam gases sob alta pressão ou em condições muito baixas de temperatura, condições às quais as leis dos gases ideais não são exatamente obedecidas. Nesses casos, o comportamento se assemelha ao dos gases reais. Em relação à teoria dos gases reais e ideais, afirma-se que
- A.
em uma quantidade fixa de gás em temperatura constante, o volume é diretamente proporcional à pressão, segundo a Lei de Boyle.
- B.
o volume de uma quantidade fixa de gás sob pressão constante varia inversamente com a temperatura, segundo a Lei de Charles.
- C.
o volume ocupado por uma amostra de gás sob pressão e temperatura constantes é inversamente proporcional ao número de mols de moléculas presentes, segundo o Princípio de Avogadro.
- D.
a equação do virial é uma equação geral usada para descrever gases reais e leva em consideração as forças de atração e de repulsão intermoleculares.
- E.
a equação de van der Waals é uma equação de estado aproximada de um gás real que, independente da temperatura, inclui parâmetros relacionados somente com as forças de atração.
A respeito de um determinado hidrocarboneto, foram feitas as afirmativas a seguir.
Descora a solução de bromo em tetracloreto de carbono. Produtos iguais são formados quando se reage com ácido bromídrico na presença ou não de peróxido. Sua fórmula molecular é CnH2n-2 Esse hidrocarboneto é o- A. hex-1-ino.
- B. á -metilnaftaleno.
- C. 2,3-dimetilbut-2-eno.
- D. 1-metilciclopenteno.
- E. ciclohexeno.


