Questões de Química
Lista completa de Questões de Química para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Práticas Laboratoriais em química - FUNRIO Fundação de Apoio a Pesquisa, Ensino e Assistência (FUNRIO) - 2008
Uma das técnicas mais populares para o manuseio de amostras sólidas em espectrometria do infravermelho é o pastilhamento com KBr. Isso se deve principalmente porque o KBr
- A.
apresenta hidrólise alcalina.
- B.
possui maior transparência em freqüências baixas.
- C.
apresenta numerosos picos de absorção na região do infravermelho.
- D.
aumenta o caminho óptico da célula de absorção.
- E. transmite na maior parte do espectro infravermelho, por ser iônico.
Nos últimos anos, o ácido trans, trans-mucônico tem sido determinado na urina como indicador biológico de exposição (IBE) para benzeno. Pelas características da matriz e do analito, a análise química deste IBE poderia ser realizada por meio de cromatografia
- A.
gasosa com detector polarográfico.
- B.
gasosa com detector espectrofotométrico.
- C.
gasosa com detector de espectroscopia de emissão.
- D.
líquida com detector polarográfico.
- E.
líquida com detector de espectrometria de massa.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Grande parte dos efeitos luminosos visualizados durante shows com fogos de artifício é produzida por luminescência. Nesse fenômeno, elétrons são excitados a estados de energia mais elevados e, ao retornarem para estados mais baixos, emitem luz característica de cada espécie química. Por exemplo, sais de Sr2+ emitem radiação vermelha, enquanto sais de Cu2+, radiação azul.
Tendo o fragmento de texto acima como referência inicial, julgue os itens seguintes, a respeito da luminescência e de sua relação com a estrutura eletrônica.
O experimento de bombardeamento de uma fina folha de platina com partículas ", realizado no início do século XX pela equipe de Ernest Rutherford, permitiu explicar a razão de cada espécie química emitir radiação com uma coloração específica.
- C. Certo
- E. Errado
Química - Práticas Laboratoriais em química - FUNRIO Fundação de Apoio a Pesquisa, Ensino e Assistência (FUNRIO) - 2008
A alternativa que contém o número de onda aproximado (cm-1) do grupo carbonila no espectro de I.V., sabendo que a constante de força da ligação é igual a 1 x 103 N/m e sua massa reduzida vale 1,1 x 10-26 kg. é
- A.
2,0 x 104
- B.
1,1 x 104
- C.
5,3 x 102
- D.
1,6 x 103
- E.
3,2 x 103
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação Carlos Chagas (FCC) - 2008
Considere as Tabelas 1 e 2 abaixo.
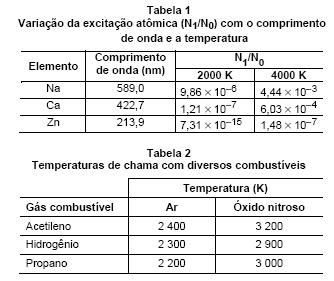
A espectroscopia de absorção atômica apresentaria maior sensibilidade na análise do elemento zinco se a composição da chama fosse
- A.
propano/ar.
- B.
propano/óxido nitroso.
- C.
hidrogênio/ar.
- D.
acetileno/óxido nitroso.
- E.
acetileno/ar.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Grande parte dos efeitos luminosos visualizados durante shows com fogos de artifício é produzida por luminescência. Nesse fenômeno, elétrons são excitados a estados de energia mais elevados e, ao retornarem para estados mais baixos, emitem luz característica de cada espécie química. Por exemplo, sais de Sr2+ emitem radiação vermelha, enquanto sais de Cu2+, radiação azul.
Tendo o fragmento de texto acima como referência inicial, julgue os itens seguintes, a respeito da luminescência e de sua relação com a estrutura eletrônica.
A menor energia que um íon Sr2+ pode emitir ao retornar para o estado fundamental a partir de um estado excitado corresponde à diferença de energia entre os orbitais 4p e 5s.
- C. Certo
- E. Errado
Química - Práticas Laboratoriais em química - FUNRIO Fundação de Apoio a Pesquisa, Ensino e Assistência (FUNRIO) - 2008
A cor que você esperaria observar para uma solução do íon Fe(ferrozina)3 4 - , que tem um máximo de absorvância no visível em 562 nm é a
- A.
Verde.
- B.
Amarela.
- C.
Azul-violeta
- D.
Vermelha
- E. Amarela-verde.
A digestão é um processo utilizado na análise gravimétrica no qual um precipitado permanece em contato prolongado com a solução em que foi formado. Essa prática permite
I. aumentar o tamanho das partículas do precipitado;
II. melhorar a filtrabilidade da mistura;
III. impedir contaminações por pós-precipitação.
É correto o que consta APENAS em
- A.
I.
- B.
II.
- C.
III.
- D.
I e II.
- E.
II e III.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
A tabela periódica foi desenvolvida a partir da segunda metade do século XIX e permitiu sistematizar os conhecimentos sobre as propriedades dos elementos químicos. Ao longo dos anos, diversas versões foram formuladas, até se chegar ao modelo atual, apresentado ao final desta prova objetiva.
Com relação à estrutura atômica dos elementos químicos, à tabela periódica e à construção dessa tabela, julgue os itens que se seguem.
O flúor apresenta raio atômico menor que o do nitrogênio.
- C. Certo
- E. Errado
Química - Práticas Laboratoriais em química - FUNRIO Fundação de Apoio a Pesquisa, Ensino e Assistência (FUNRIO) - 2008
Comparado com os instrumentos que trabalham usando dispersão, uma das vantagens do espectrômetro com transformada de Fourier é o de oferecer
- A.
melhores condições de aquisição do equipamento.
- B.
exatidão de valores de freqüência pior.
- C.
melhor relação sinal/ruído para uma dada resolução.
- D.
maior biblioteca de dados.
- E. menor tempo para a aquisição dos dados.


