Questões de Química do ano 0000
Lista completa de Questões de Química do ano 0000 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Metais pirofóricos, como sódio (Na), zinco (Zn), magnésio (Mg), potássio (K), bário (Ba), cálcio (Ca), alumínio (Al), zircônio (Zr) e titânio (Ti), podem sofrer ignição instantânea ao entrarem em contato com umidade ou oxigênio e causar incêndios classificados como de classe D. Portanto esses metais devem ser estocados em atmosfera inerte ou em óleos minerais. O potássio, por exemplo, reage explosivamente com água, devido à liberação de hidrogênio. O bário, ao ser queimado, forma chamas coloridas de altíssimas temperaturas. As equações químicas não balanceadas, apresentadas a seguir, ilustram esses processos.
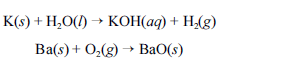
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
Considerando-se o valor aproximado de 6 × 1023 mol-1 para a constante de Avogadro, infere-se que, quando são colocados 1,8 × 1024 átomos de bário e 2 mols de gás oxigênio em reação, formam-se mais de 400 g de BaO.- C. Certo
- E. Errado
Metais pirofóricos, como sódio (Na), zinco (Zn), magnésio (Mg), potássio (K), bário (Ba), cálcio (Ca), alumínio (Al), zircônio (Zr) e titânio (Ti), podem sofrer ignição instantânea ao entrarem em contato com umidade ou oxigênio e causar incêndios classificados como de classe D. Portanto esses metais devem ser estocados em atmosfera inerte ou em óleos minerais. O potássio, por exemplo, reage explosivamente com água, devido à liberação de hidrogênio. O bário, ao ser queimado, forma chamas coloridas de altíssimas temperaturas. As equações químicas não balanceadas, apresentadas a seguir, ilustram esses processos.

Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
O estado de oxidação do bário é mais reduzido na forma metálica desse elemento que na estrutura da substância que resulta como produto de sua queima.- C. Certo
- E. Errado
Metais pirofóricos, como sódio (Na), zinco (Zn), magnésio (Mg), potássio (K), bário (Ba), cálcio (Ca), alumínio (Al), zircônio (Zr) e titânio (Ti), podem sofrer ignição instantânea ao entrarem em contato com umidade ou oxigênio e causar incêndios classificados como de classe D. Portanto esses metais devem ser estocados em atmosfera inerte ou em óleos minerais. O potássio, por exemplo, reage explosivamente com água, devido à liberação de hidrogênio. O bário, ao ser queimado, forma chamas coloridas de altíssimas temperaturas. As equações químicas não balanceadas, apresentadas a seguir, ilustram esses processos.

Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
No material base que compõe o pó químico dos extintores utilizados contra incêndios classe D, a espécie química cloro apresenta a configuração eletrônica 1s22s2 2p6 3s2 3p5, conforme o diagrama de Linus Pauling.- C. Certo
- E. Errado
Uma certa quantidade de PCl5 gasoso foi aquecida a 25 °C num recipiente com 12 litros de capacidade, formando PCl3 gasoso e gás cloro. No equilíbrio, foi constatada a presença de 0,21 mols de PCl5, 0,32 mols de PCl3 e 0,32 mols de gás cloro. A constante de equilíbrio para a dissociação de PCl5, a 25 °C, é de:
- A. 0,015.
- B. 0,012.
- C. 0,041.
- D. 0,078.
- E. 0,086.
A solubilidade do cromato de prata em água é igual a 0,022 g/L. O produto de solubilidade, do composto mencionado é de:
Dados: Ag = 108 e Cr = 52
- A. 1,1 x 10-12
- B. 2,2 x 10-8
- C. 4,4 x 10-9
- D. 5,6 x 10-10
- E. 9,8 x 10-14
A quantidade, em Coulombs, que são consumidos por uma cuba onde são produzidos 245 g de NaClO4 a partir de NaClO3, sabendo-se que a eficiência anódica é de apenas 60%, é de:
Dados: Na = 23 / Cl = 35,5 e O = 16
- A. 3,2 x 103
- B. 4,5 x 104
- C. 7,5 x 106
- D. 6,4 x 105
- E. 8,6 x 107
Um determinado químico observou que uma amostra radioativa de F18 sofre desintegração de 90% em 366 minutos. Baseado nessa constatação, a meia-vida, em minutos, do elemento radioativo é, de aproximadamente:
- A. 110.
- B. 100.
- C. 90.
- D. 80.
- E. 75.
Aos alimentos industrializados são acrescentados conservantes em função do tempo que ficarão nas prateleiras à espera dos consumidores. Observe os conservantes a seguir.
I Nitrito de sódio, adicionado em conserva de carne e pescado.
II Ácido benzoico, empregado em concentrados de frutas para refrigerantes.
III Propanoato de sódio, adicionado em chocolates e queijos.
IV Dióxido de enxofre, empregado em bebidas alcoólicas.
São compostos orgânicos os conservantes que constam dos itens:
- A. I e II.
- B. I e III.
- C. I e IV.
- D. II e III.
- E. II e IV.
Ao se introduzir uma barra de ferro e chumbo numa solução aquosa de sulfato de zinco, a reação:
- A. é denominada de síntese ou de adição.
- B. vai ocorrer produzindo sulfato de chumbo II.
- C. é chamada de dupla troca ou deslocamento.
- D. não ocorre, porque o chumbo é menos reativo que o zinco.
- E. vai ocorrer, produzindo SO3, chumbo e zinco na água.
Os elementos A e B têm, respectivamente, 2 e 6 elétrons na camada mais externa. Se A e B se ligarem, formará um composto cuja fórmula é:
- A. AB
- B. AB2
- C. A2B3
- D. A2B
- E. AB3


