Questões de Química do ano 2008
Lista completa de Questões de Química do ano 2008 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Práticas Laboratoriais em química - FUNRIO Fundação de Apoio a Pesquisa, Ensino e Assistência (FUNRIO) - 2008
A melhor definição para o tempo de retenção em cromatografia gasosa é
- A.
o tempo necessário para que uma espécie não retida passe pela coluna.
- B.
o tempo entre a injeção de uma amostra e o aparecimento do pico do soluto no detector de uma coluna.
- C.
proporcional à concentração do soluto que passa pela coluna.
- D.
a plotagem da concentração do soluto em função ao volume do eluente.
- E.
descreve a forma pela qual o soluto passa pela coluna.
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008

Apesar de a composição quali e quantitativa de íons presentes na água do mar variar em amostras coletadas em diferentes mares e oceanos, a proporção relativa dos principais íons, como Na+
é aproximadamente constante. Assim, se, para uma amostra de
água do mar, a porcentagem de íons Na+ for de 25,0%, então a
porcentagem de íons CR- será
- A.
inferior ou igual a 20%.
- B.
superior a 20% e inferior ou igual a 30%.
- C.
superior a 30% e inferior ou igual a 40%.
- D.
superior a 40% e inferior ou igual a 50%.
- E.
superior a 50%.
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008

A respeito da composição média de amostras de água do mar e de água doce mostrada na tabela, assinale a opção correta.
- A.
Íons sódio e cloreto, componentes do sal de cozinha, constituem 61,2% dos íons dissolvidos na água do mar.
- B.
Águas doces não possuem sabor salgado marcante, pois contêm apenas 10% da quantidade de íons sódio e cloreto presentes na água do mar.
- C.
Íons cálcio e bicarbonato correspondem a quase 50% dos íons dissolvidos na água de rios, porém constituem menos que 2% dos íons dissolvidos na água dos oceanos.
- D.
Rios carregam mais íons cálcio que íons cloreto para os oceanos, porém os oceanos contêm 25 vezes mais íons cloreto dissolvidos que cálcio.
- E.
A água do mar e a água doce são meios considerados maus condutores de eletricidade.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
As moléculas responsáveis pela ação de limpeza em produtos detergentes possuem uma estrutura química com características que podem ser representadas esquematicamente pelo desenho abaixo. Em meio aquoso, essas moléculas se associam formando agregados esféricos conhecidos como micelas. Como as micelas possuem dimensão coloidal, as misturas de água e detergente são dispersões coloidais, e não soluções. Além do uso na limpeza doméstica, detergentes podem ser adicionados a óleos lubrificantes de motores, prevenindo o acúmulo de resíduos de carvão nos pistões. Com relação a detergentes e suas dispersões coloidais e tendo o texto acima como referência, assinale a opção correta. 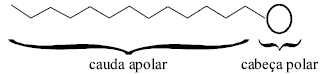
- A.
A cauda da molécula de um detergente é hidrofílica, enquanto a cabeça é hidrofóbica.
- B.
Nas micelas formadas em meio aquoso, as moléculas de detergentes têm a cabeça polar voltada para o seu interior e a cauda apolar voltada para o exterior do agregado esférico em contato com o solvente.
- C.
Moléculas de detergente possuem propriedades tensoativas, ou surfactantes, pois aumentam a tensão superficial da água e facilitam o processo de lavagem.
- D.
A ação de limpeza de detergentes deve-se à sua capacidade de aprisionar gotículas de óleo ou partículas de carvão no interior das micelas.
- E.
A espuma produzida pela mistura de água e detergente é responsável pela ação de limpeza dos detergentes.
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Óleo lubrificante automotivo usado, observado a olho nu, é um material homogêneo, porém pode ser considerado heterogêneo se for observado por meio de um microscópio, pois nele estão dispersos macromoléculas, agregados moleculares ou partículas com dimensões entre 1 a 1.000 nm. Materiais que possuem esse comportamento são classificados como colóides e, dependendo do estado físico da fase dispersa e do meio de dispersão, os colóides podem receber denominações bem específicas. A tabela a seguir apresenta alguns exemplos dessa classificação de colóides. Com base nessas informações, neblina, fumaça com fuligem, espuma de sabão e pasta de dente são colóides classificados, respectivamente, como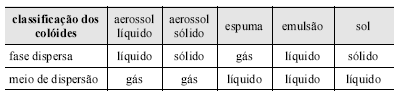
- A.
aerossol líquido, aerossol sólido, espuma e sol.
- B.
aerossol sólido, aerossol líquido, espuma e emulsão.
- C.
aerossol líquido, aerossol sólido, espuma e emulsão.
- D.
espuma, aerossol sólido, aerossol líquido e emulsão.
- E.
espuma, aerossol líquido, emulsão e sol.
O petróleo é ainda a principal fonte de energia para diversos setores da economia. Da extração do petróleo até a utilização de seus componentes, há um longo caminho. Sendo o petróleo uma mistura complexa de compostos com predominância de hidrocarbonetos de cadeia linear, uma das primeiras etapas da refinação do óleo cru consiste em separar a mistura em frações mais simples por destilação fracionada. A tabela a seguir mostra o nome de algumas das principais frações destiladas do petróleo e as respectivas faixas de temperatura de ebulição. 
- A.
I e II.
- B.
I e III.
- C.
II e IV.
- D.
III e V.
- E.
IV e V.
A queima de pequenas amostras de compostos orgânicos pode fornecer informações estruturais importantes, tais como: I hidrocarbonetos queimam e sustentam a chama acesa após a ignição com mais facilidade que compostos que contêm oxigênio ou nitrogênio; II em hidrocarbonetos, quanto maior for o grau de insaturação, mais fuligem é produzida; III compostos halogenados não sustentam a chama acesa após a ignição. Esse é o princípio do teste de chama e permite a caracterização de muitos materiais poliméricos descartados no lixo. O teste é muito simples e consiste basicamente em se queimar, na chama de um bico de Bunsen, uma pequena amostra do material na presença de ar. Representações simplificadas das estruturas de alguns polímeros conhecidos são mostradas a seguir. Tendo como referência o texto acima e com relação ao princípio do teste de chama em amostras dos polímeros apresentados, assinale a opção correta.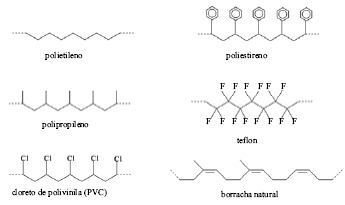
- A.
Os polímeros que sustentam a chama acesa após ignição são: polietileno, polipropileno, borracha natural e PVC.
- B.
Apenas o teflon não sustenta a chama acesa após a ignição.
- C.
O polímero que tem menos facilidade para sustentar a chama acesa após ignição é o poliestireno.
- D.
Apenas o poliestireno e a borracha natural queimam com produção de muita fuligem.
- E.
Apenas o polietileno e o polipropileno queimam com produção de muita fuligem.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008

- A.
A formação de ferrugem é um exemplo de transformação física do ferro.
- B.
A evaporação da água do meio favorece a corrosão do ferro.
- C.
Sabendo que a concentração de O
2 nos oceanos tende adiminuir com a profundidade, é correto afirmar que a
corrosão do ferro em estruturas submersas é maior próximo
à superfície do oceano.
- D.
Se a reação no sentido direto for exotérmica, o aumento da temperatura favorecerá a corrosão do ferro.
- E.
O valor da constante de equilíbrio da reação no sentido direto é igual ao da constante de equilíbrio no sentido inverso.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008

A respeito do perfil energético e da equação química que representam a reação de combustão do C
assinale a opção correta.
- A.
A combustão do hidrocarboneto é um processo endotérmico, pois requer energia de ativação para que se inicie.
- B.
A variação de entalpia do processo é negativa, pois a entalpia dos produtos é menor que a entalpia dos reagentes.
- C.
A equação mostrada é de uma combustão incompleta, pois a combustão completa de um hidrocarboneto gera monóxido de carbono (CO) e fuligem (C), além de água.
- D.
O valor da entalpia de combustão (
ΔHcomb) de umhidrocarboneto à pressão constante é o mesmo para uma
combustão completa e para uma combustão incompleta.
- E.
Quanto maior for a entalpia de combustão (
ΔHcomb ) de umhidrocarboneto, menor será a energia liberada para as
vizinhanças na forma de calor.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008

Acerca da equação química que representa a reação de combustão apresentada no texto, assinale a opção correta.
- A.
Os coeficientes estequiométricos dos dois reagentes e dos dois produtos, na ordem mostrada na equação, são, respectivamente, 41, 2, 3 e 3.
- B.
Os coeficientes estequiométricos dos dois reagentes e dos dois produtos, na ordem mostrada na equação, são, respectivamente, 41, 40, 39 e 42.
- C.
Pela estequiometria da reação, 1 mol de C 13 H 28 consome 2 mols de oxigênio.
- D.
De acordo com a Lei de Conservação de Massa, 1 mol de
C
13H28, ao reagir com excesso de oxigênio, gera 13 mols degás carbônico.
- E.
De acordo com a Lei de Conservação de Massa, cada grama
de C
13H28, ao reagir com excesso de oxigênio, geraexatamente 1 g de gás carbônico.


