Questões de Química do ano 2008
Lista completa de Questões de Química do ano 2008 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Os principais problemas causados pela disposição inadequada do lixo gerado pela sociedade são a poluição do solo e dos lençóis freáticos, a proliferação de insetos e roedores transmissores de doenças, e o acúmulo de materiais nãodegradáveis ou tóxicos. Devido a características físico-químicas próprias, cada tipo de material descartado como lixo pode ter um destino específico ou ser reciclado. Alguns materiais recicláveis são: vidro, papel, plástico, metal e óleo de motor. Sobre a reciclagem de vidro e metais em geral e a variação de entalpia associada a processos de fusão (
(ΔHsolid) à pressão constante, assinale a opção correta.
- A.
Sabendo que uma das etapas da reciclagem de metais e vidros é a fusão, é correto concluir que essa etapa é exotérmica.
- B.
Sabendo que uma das etapas da reciclagem de metais e vidros é a fusão, é correto concluir que essa etapa é exotérmica.
- C.
A variação de entalpia de processos de solidificação de vidros e metais fundidos é positiva.
- D.
A variação de entalpia de processos de solidificação de vidros e metais fundidos é positiva.
- E.
Para um mesmo metal à temperatura ambiente,
Δ
Hfus = -ΔHsolid.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008

- A.
Na equação I, o ácido sulfúrico sofre redução pela ação do carbonato de cálcio, que age como agente redutor.
- B.
Na equação II, o zinco metálico é dissolvido pela ação oxidante do ácido sulfúrico.
- C.
A dissolução do zinco pelo ácido sulfúrico é um exemplo de reação ácido-base.
- D.
Na equação II, os átomos de hidrogênio do ácido sulfúrico não sofrem oxidação nem redução, apenas se dissociam gerando gás hidrogênio.
- E.
A corrosão do calcário pelo ácido sulfúrico é um exemplo de reação de oxirredução.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Chuva ácida é o termo usado para descrever chuva e neve que possuem acidez acima do normal. A chuva ácida é responsável por muitos problemas ambientais, pois altera o pH do solo e de ambientes aquáticos, colocando em risco a sobrevivência de plantas, peixes e outros organismos. Diversos gases gerados na queima de combustíveis fósseis em fornos de indústrias e motores de veículos fazem o pH da chuva ficar até 3 unidades abaixo do seu pH normal, chegando a valores próximos de 2. Os principais gases que provocam a chuva ácida são o dióxido de enxofre (SO2 )
A partir das informações apresentadas no texto, assinale a opção correta.
- A.
O pH normal da chuva é menor que 2.
- B.
O pH normal da chuva é neutro.
- C.
A chuva ácida traz benefícios às lavouras.
- D.
Quanto maior for a concentração de ácido sulfúrico na água da chuva, menor será o pH dessa solução.
- E.
A chuva é um exemplo de solução aquosa alcalina.
Na reação a seguir, o etanol, presente no vinho, reage com uma substância X e transforma-se em ácido acético.
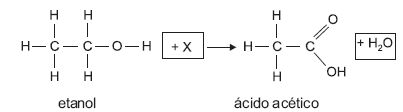
A substância X corresponde a:
- A.
H2
- B.
O2
- C.
CO2
- D.
C2H4
- E.
H2O2
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Considerando que o processamento químico de certo petróleo tenha envolvido as seguintes etapas:
I craqueamento — processo pelo qual moléculas de maior massa molecular são "quebradas" para produzir moléculas com menor massa molecular;
II reforma catalítica — processo que envolve a combinação de moléculas menores para formar outras de maior massa;
III alquilação — 0, processo em que compostos de baixa massa molecular, como o propileno e o buteno, são misturados na presença de um catalisador como o ácido fluorídrico ou ácido sulfúrico (um subproduto da remoção de impureza de muitos produtos do petróleo). Os produtos da alquilação são hidrocarbonetos ricos em octanas.
Com relação ao processamento químico do petróleo descrito acima, assinale a opção correta.
- A.
As moléculas obtidas após o craqueamento apresentam maior ponto de ebulição quando comparadas àquelas que lhes deram origem.
- B.
Os compostos orgânicos de baixa massa molecular mencionados nesse processo são hidrocarbonetos.
- C.
Os compostos orgânicos de baixa massa molecular mencionados nesse processo são isômeros.
- D.
Os processos I e II são químicos, ao passo que o processo III é físico.
- E.
Os produtos da alquilação são ricos em compostos com cadeias de 10 átomos de carbono.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008

Considerando as informações acima, julgue os itens a seguir.
I O processo mencionado para a produção de H 0 envolve a redução do H.
II Na reação apresentada acima, não há mudança no estado de oxidação do S após a remoção do filme superficial.
III O pH não interfere no processo de corrosão.
IV Considerando M(C) = 12 g/mol, M(N) = 14 g/mol, M(S) = 32 g/mol e M(Fe) = 56 g/mol, é correto afirmar que cada 4,4 g de FeS pode produzir 3,2 g de S -2 .
Estão certos apenas os itens
- A.
I e II.
- B.
I e III.
- C.
II e IV.
- D.
I, III e IV.
- E.
II, III e IV.
Considere que a Lagoa Rodrigo de Freitas, no Rio de Janeiro, tenha uma profundidade máxima de 20 m e esteja submetida a uma pressão atmosférica média de 90 kPa. Nessa situação, e assumindo que o peso específico da água igual seja 10.000 N/m 2 e que 10 5 Pa = 1 bar = 1 N/m 2 , o valor da pressão absoluta em kPa na profundidade máxima é igual a
- A.
250.
- B.
270.
- C.
280.
- D.
290.
- E.
300.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Especialmente nas destilações, as colunas de pratos são muito mais usadas que as recheadas. As características desejáveis do material de recheio de colunas de pratos não incluem
- A.
resistência à corrosão.
- B.
grande densidade volumar.
- C.
área interfacial elevada.
- D.
grande volume de vazios.
- E.
grande volume de vazios.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
No que diz respeito à relação entre fases, assinale a opção incorreta.
- A.
Se uma mistura líquida é vaporizada, ocorre, na sua entalpia, um aumento de grandeza igual ao calor latente de vaporização.
- B.
Um vapor no seu ponto de orvalho é chamado vapor saturado, assim como um líquido no seu ponto de bolha é um líquido saturado
- C.
No caso de uma solução binária, o ponto de orvalho e o ponto de bolha são funções da variação de volume.
- D.
Na composição de um azeótropo, o ponto de orvalho é coincidente com o ponto de bolha.
- E.
Em um sistema azeotrópico, a solução líquida vaporiza-se em uma temperatura constante.
Em relação ao equilíbrio líquido-líquido, assinale a opção correta.
- A.
Não há influência da concentração do soluto sobre a solubilidade do solvente.
- B.
Os dados podem ser registrados, para as fases em equilíbrio, como as razões entre as massas de soluto e solvente em cada uma delas.
- C.
Duas variáveis independentes são necessárias para descrever o sistema, de acordo com a regra de fases.
- D.
Na extração em fase líquida, há transferência do soluto para uma fase mais solúvel.
- E.
Cálculos com concentrações baixas de soluto diminuem a exatidão gráfica em sistemas ternários.


