Questões de Química do ano 2011
Lista completa de Questões de Química do ano 2011 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.

- A.
1,0.10−12 mol/L
- B.
2,0.10−10 mol/L
- C.
1,0.10−10 mol/L
- D.
2,0.10−8 mol/L
- E.
1,0.10−8 mol/L
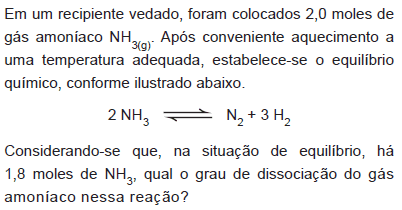
- A.
10%
- B.
20%
- C.
45%
- D.
90%
- E.
100%

- A.
65 g
- B.
72 g
- C.
88 g
- D.
130 g
- E.
144 g
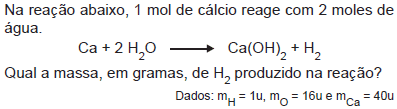
- A.
40,0
- B.
20,0
- C.
10,0
- D.
2,0
- E.
1,0

- A.
I e S
- B.
I e H
- C.
H e O
- D.
O e I
- E.
S e I

- A.
50 e 1,0 x 10-3
- B.
15 e 2,0 x 10-3
- C.
15 e 1,0 x 10-4
- D.

- E.


- A.
90
- B.
100
- C.
500
- D.
900
- E.
1.000
De acordo com o conceito de Arrhenius, substâncias ácidas, na presença de água,
- A.
liberam íons OH- e não liberam íons H+.
- B.
liberam íons H+ e não liberam íons OH-.
- C.
liberam íons H+ e OH-.
- D.
não sofrem ionização.
- E.
liberam CO2.
A cromatografia é amplamente utilizada em análises de gases e líquidos para a determinação dos componentes químicos contidos em uma amostra. A esse respeito, afirma-se que
- A.
a cromatografia gasosa é constituída pelas fases móvel e estacionária.
- B.
os componentes de uma mistura que possuem o mesmo ponto de ebulição são separados na cromatografia gasosa.
- C.
um gás de arraste, para transportar a amostra através da coluna de separação até o detector, é utilizado na fase estacionária.
- D.
os gases de arraste para coluna de líquido devem ser quimicamente miscíveis e possuir baixa pureza.
- E.
os detectores são dispositivos que transformam as variações na composição do gás de arraste em sinais pneumáticos.
O fogo surgiu junto à tomada elétrica de piso da sala, próximo à lixeira de papel. Havia vários computadores funcionando, ligados àquela tomada através de um dispositivo improvisado. Naquela sala, a ventilação natural era propiciada por amplas janelas, por onde entrava o vento em corrente. Dois equipamentos estavam disponíveis para o combate àquele princípio de incêndio: ambos eram aparelhos portáteis, sendo, o primeiro, de dióxido de carbono, e o outro, de pó químico. Da equipe de trabalho naquele local, no momento, fazia parte um Técnico em Logística de Transporte que pertencia à Brigada de Incêndio da unidade de negócios. Imediatamente ele definiu, com êxito, o segundo dos aparelhos disponíveis, como o mais eficaz para a extinção daquele pequeno foco de fogo porque apresentava as vantagens de
- A.
manter a temperatura do local, sem interferir no processo de resfriamento do ponto de origem do fogo que, assim, extingue-se de forma gradual por abafamento.
- B.
sofrer menos influência da corrente de ar existente em seu agente extintor, e apagar o fogo com maior velocidade por interferir diretamente na reação em cadeia do fogo.
- C.
umedecer o local e deixar pouco resíduo prejudicial na posterior operação de rescaldo ou na recuperação dos equipamentos expostos à sua ação durante o combate ao fogo.
- D.
ser mais suscetível à aerodispersão do pó químico, o que gera resfriamento numa área mais extensa, além de o fato do extintor de pó químico ser mais pesado que o dióxido de carbono.
- E.
ser volátil, misturando-se com o ar atmosférico e, assim, ser mais facilmente transportado na corrente de ar, até o ponto onde estão surgindo as chamas, que logo se retraem.


