Questões de Química do ano 2011
Lista completa de Questões de Química do ano 2011 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Em um ambiente rico em oxigênio, dentro dos limites de explosividade, o fogo terá suas chamas
- A.
aumentadas, desprendendo mais luz e gerando maior quantidade de calor.
- B.
aumentadas, desprendendo mais luz e gerando menos quantidade de calor.
- C.
aumentadas, desprendendo menos luz e gerando menos quantidade de calor.
- D.
diminuídas, desprendendo mais luz e gerando maior quantidade de calor.
- E.
diminuídas, desprendendo menos luz e gerando menor quantidade de calor.
Admitindo-se que os componentes do fogo sejam simbolicamente representados por um triângulo, se uma das faces desse triângulo for retirada, o fogo
- A.
aumentará.
- B.
se espalhará.
- C.
será extinto.
- D.
produzirá mais chama.
- E.
causará uma explosão.
Um combustível líquido, após ter a sua temperatura elevada e atingir seu ponto de fulgor, gera
- A.
vapores inflamáveis, que reagirão com o oxigênio do ar produzindo fogo.
- B.
vapores inflamáveis, que reagirão com o gás carbônico do ar entrando em combustão.
- C.
vapores inflamáveis, que reagirão com o nitrogênio do ar produzindo chamas.
- D.
líquidos inflamáveis, que reagirão com o gás carbônico do ar entrando em combustão.
- E.
sólidos inflamáveis, que reagirão com o oxigênio do ar entrando em combustão.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação CESGRANRIO (CESGRANRIO) - 2011
Para que um combustível sólido entre em combustão, inicialmente, deve ocorrer sua transformação para outro estado físico pela ação do calor, para se combinar com um determinado elemento e produzir fogo. Esse estado físico e o determinado elemento são, respectivamente,
- A.
líquido e comburente
- B.
líquido e luz
- C.
gasoso e comburente
- D.
gasoso e luz
- E.
gasoso e calor
Até bem pouco tempo, não se conhecia o plástico e, pensar que hoje não se vive sem ele! Já são conhecidos mais de 60 mil plásticos diferentes. Muitos desses fazem parte do nosso dia a dia e, infelizmente, são descartados de forma irresponsável, contribuindo com a poluição que assola o planeta. Um desses plásticos, o polietileno, por exemplo, faz parte da maioria dos plásticos produzidos no mundo. É muito empregado industrialmente para a fabricação de diferentes tipos de embalagens, recipientes, brinquedos, isolantes elétricos etc. São conhecidos os PEAD (Polietilenos de Alta Densidade e Mais Rígidos) e os PEBD (Polietilenos de Baixa Densidade e mais Flexíveis). É um polímero de moléculas longas, mas seu monômero é o etileno, cuja fórmula está melhor representada em:
- A.

- B.

- C.

- D.

- E.

Para nos manter vivos, o pH do sangue deve estar neutro entre 7,35 e 7,45. Uma pequena alteração pode matar. Numa crise de ansiedade ou histeria, quando se respira de modo ofegante, perde-se muito CO2. Isso faz com que o pH do sangue suba a 7,7 em poucos minutos, situação conhecida como alcalemia sanguínea. Às vezes, a ingestão de um simples calmante resolve o problema, a respiração volta ao normal e o sangue reestabelece o pH neutro. No sangue, o equilíbrio químico é dado pela equação: CO2 + H2O H+ + HCO3 Consumindo-se muito CO2, o equilíbrio se desloca para a esquerda consumindo os íons H+ e o sangue apresenta caráter básico. Se isso não funciona, é preciso uma intervenção médica injetando uma solução ácida de cloreto de amônio no sangue do paciente. O fato de um sal produzir a acidez necessária para neutralizar o sangue, pode ser explicado na seguinte alternativa:
H+ + HCO3 Consumindo-se muito CO2, o equilíbrio se desloca para a esquerda consumindo os íons H+ e o sangue apresenta caráter básico. Se isso não funciona, é preciso uma intervenção médica injetando uma solução ácida de cloreto de amônio no sangue do paciente. O fato de um sal produzir a acidez necessária para neutralizar o sangue, pode ser explicado na seguinte alternativa:
- A.
Ao dissolver o NH4Cl em água, o íon NH4 + derivado de uma base forte, captura os íons OH.
- B.
O NH4Cl dissolvido em água derivado de uma base fraca, faz sobrar H+ tornando-se ácida.
- C.
O cloreto de amônio não pode ser ministrado no organismo por ser derivado de um ácido forte.
- D.
Na água pura, existe H2O e íons H+ (responsável pela acidez) e OH (responsável pela basicidade) em concentrações diferentes.
- E.
É preciso uma solução ácida para neutralizar a alcalemia, reestabelecer o equilíbrio e manter o pH a níveis aceitáveis.
O refluxo ou azia é um mal que atinge grande parcela da população, podendo afetar até os bebês, e provoca uma sensação de queimação no estômago, podendo ter sido causada por motivos emocionais ou má alimentação. Pode ser explicada pelo excesso de acidez do suco gástrico (ácido clorídrico) que, de tão alta, evidencia e faz perceber a irritação causada nas paredes do trato digestivo. Para combatê-la, pode-se usar medicamentos que contêm antiácidos como o hidróxido de alumínio ou o hidróxido de magnésio necessários para neutralizar essa acidez. Ao ingerir esses antiácidos, provoca-se uma reação de neutralização que pode ser descrita em:
- A.
2HCl(aq) + Mg(OH)2(aq) ¨ MgCl2(aq) + H2O(l)
- B.
HCl(aq) + Al(OH)3(aq) ¨AlCl3(aq) + H2O(l)
- C.
HCl(aq) + Mg(OH)2(aq) ¨MgCl2(aq) + H2O(l)
- D.
3HCl(aq) + Mg(OH)2(aq) ¨ MgCl2(aq) + H3O+ (l)
- E.
3HCl(aq) + Al(OH)3(aq) ¨ AlCl3(aq) + 3 H2O(l)
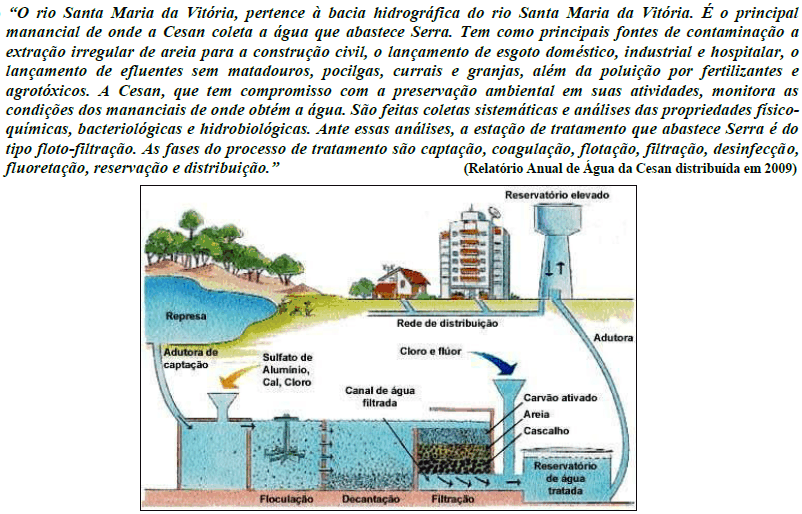
A fluoretação da água de abastecimento público representa uma das principais e mais importantes medidas de saúde pública no controle da cárie dentária. O flúor pode ser acrescentado à água potável a partir de seus compostos mais comuns: ácido fluorsilíaco (H2SiF6), fluoreto de cálcio (CaF2), fluorsilicato de sódio (Na2SiF6) e o fluoreto de sódio (NaF). A concentração ótima na maioria das cidades brasileiras (país tropical) é 0,7ppm. Considerando que uma pessoa deve tomar pelo menos dois litros de água por dia, qual a quantidade, em gramas, de flúor ingerimos?
- A.
1,4
- B.
1,4.103
- C.
7.101
- D.
1,4.103
- E.
7.101
O mercúrio (Hg) é um metal que, à temperatura ambiente, é líquido e de cor prata. Esse metal é utilizado nos termômetros caseiros, mas é também bastante utilizado para separar metais como o ouro e a prata em garimpos. Um processo utilizado para isolar os metais faz com que o mercúrio evapore, contaminando o meio ambiente. Essa contaminação ocorre diretamente com o despejo dos resíduos no rio ou retornando com a chuva após a evaporação. A análise da água de um rio contaminado revelou uma concentração de 5.105 mol/L de mercúrio (M = 200,59). Alguém que bebeu dessa água, absorveu por via gastrointestinal, 5,02mg desse metal. Quantos copos de água essa pessoa ingeriu? (1copo 250ml)
- A.
0,5 copo.
- B.
1 copo.
- C.
1,5 copos.
- D.
2 copos.
- E.
2,5 copos.

Diante do exposto, analise:
I. O Manganês é o agente oxidante.
II. O Carbono sofre oxidação.
III. O Enxofre é o redutor.
IV. Na equação balanceada, a soma dos coeficientes inteiros dos reagentes é 15.
V. É uma reação irreversível.
Estão corretas apenas as afirmativas:
- A.
II, III, IV
- B.
I, II, IV
- C.
III, IV
- D.
II, III, V
- E.
I, II, III


