Questões de Química do ano 2011
Lista completa de Questões de Química do ano 2011 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Analise as afirmativas:
I. O fósforo possui várias formas alotrópicas.
II. O ozônio é uma substância pura simples.
III. O oxigênio é uma substância pura composta, formada por dois átomos.
IV. O ozônio é uma forma alotrópica estável do oxigênio, utilizado na purificação da água.
Está(ão) correta(s) apenas a(s) afirmativa(s):
- A.
I, II, III, IV
- B.
I, II, III
- C.
I, III, IV
- D.
II, IV
- E.
II

Sabendo que se trata de um carboidrato e, quimicamente falando, os açúcares se dividem em aldoses e cetoses, que funções orgânicas esse açúcar apresenta?
- A.
Aldeído e Éster.
- B.
Cetona e Poliálcool.
- C.
Aldeído e Éter.
- D.
Cetona e Éster.
- E.
Aldeído e Poliálcool.
Até 1960, os detergentes apresentavam, na sua constituição, cadeias ramificadas, o que dificultava sua decomposição pelos micro-organismos presentes nos rios e lagos. E, com a agitação das águas, formavam uma camada de espuma, que dificulta a oxigenação da água. Mas a preocupação ambiental fez com que surgissem leis para produzirem detergentes com cadeias retas, semelhantes com as dos sabões. Na reação de saponificação: H3CCOOCH2CH3 + NaOH → X + Y, quais são os produtos X e Y da reação?
- A.
Etanoato de sódio e álcool etílico.
- B.
Proprionato de sódio e etanodiol.
- C.
Etanona de sódio e álcool etílico.
- D.
Acetato de sódio e etanol.
- E.
Acetato de sódio e álcool propílico.
A rede de esgoto mais antiga que se tem notícia foi construída no Paquistão, há cerca de 2500 a.C. Grandes tubos feitos de argila levavam águas residuais e detritos para canais cobertos que corriam ao longo das ruas e íam até os campos servindo de adubo e regando as colheitas. Algumas cidades gregas e romanas também apresentavam sistema de esgotos. Quando o Império Romano começou a perder o poder, os sistemas de esgoto europeus caíram em desuso e se deterioraram. A falta de saneamento básico culminou na proliferação de epidemias, como o cólera e a febre tifoide, que provocou a morte de milhares de pessoas. Claro que as condições de saneamento público hoje, compromisso da Cesan, junto à coleta de lixo, são medidas responsáveis pelo aumento da expectativa de vida da população moderna. Parte do tratamento consiste em manter o pH da água neutro. A portaria do MS nº. 518/2004 recomenda que a água distribuída mantenha o pH entre 6,0 e 9,5. Para isso, utiliza-se substâncias de caráter básico ou ácido como a cal, o carbonato de sódio, o hidróxido de sódio, o ácido sulfúrico e a dolomita.
- A.
CaOH (base), Na2CO3 (sal), Na2O (óxido), H2SO4 (ácido), CaCO3(sal).
- B.
CaOH (base), NaCO3 (sal), Na (OH)2 (base), H2SO3 (ácido), Mg(CO3)2(sal).
- C.
CaO (óxido), Na2CO3 (sal), NaOH (base), H2SO4 (ácido), CaMg(CO3)2(sal).
- D.
CaO (óxido), NaHCO3 (sal), NaO (óxido), H2SO4 (ácido), CaMg(CO3)2(sal).
- E.
Ca(OH)2 (base), NaHCO3 (sal), Na2O (óxido), H2SO3 (ácido),CaMg(CO3)2.
A enorme quantidade de sabões e detergentes lançada nos rios e lagos diariamente acaba atingindo níveis de concentração nocivos ao meio ambiente. Apesar dos detergentes serem mais eficientes na remoção da gordura, os sabões são preferíveis, por serem bastante biodegradáveis. O uso contínuo e em escala cada vez maior de sabões pode acarretar
- A.
a formação de manchas de óleo na superfície das águas.
- B.
a alteração do pH da água nos reservatórios naturais.
- C.
a proliferação de algas.
- D.
o aumento da concentração de materiais fosfatados nos reservatórios.
- E.
a morte de micro-organismos anaeróbicos.
Considere o sistema:
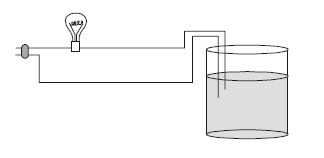
No sistema representado acima, uma lâmpada de 40 watts deve acender quando o líquido existente no béquer for
- A.
água + sacarose (C12H22O11).
- B.
água destilada.
- C.
NaOH (aq).
- D.
gasolina.
- E.
etanol.
Ao se colocar gelo-seco em um béquer contendo uma solução rosa de NaOH 0,1 mol/l com fenolftaleína, verificase que a mesma descora. Isso acontece porque
Dado: Faixa de viragem da fenolftaleína: de pH 8,2 a 10,0
- A.
os íons OH- aumentaram na solução.
- B.
o pH da solução aumentou.
- C.
o pH da solução diminuiu.
- D.
o gelo-seco é constituído por moléculas com acentuada polaridade.
- E.
o gelo-seco sofreu sublimação.
A ureia, (NH2)2CO, pertence à função química
- A.
aldeído.
- B.
amida.
- C.
amina.
- D.
álcool.
- E.
cetona.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação Carlos Chagas (FCC) - 2011
Considere:
I. bronze.
II. bromo.
III. ouro.
IV. gás carbônico.
V. ar.
VI. granito.
Pertencem ao grupo das substâncias puras
- A.
bromo, ouro e gás carbônico.
- B.
bronze, ouro e granito.
- C.
bromo, granito e gás carbônico.
- D.
ar, bronze e gás carbônico.
- E.
ar, ouro e gás carbônico.








