Questões de Química do ano 2011
Lista completa de Questões de Química do ano 2011 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
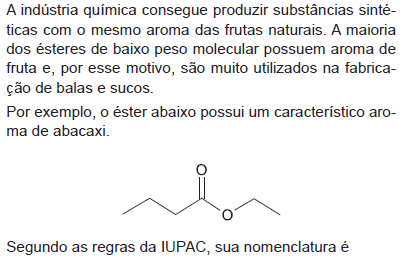
- A.
acetato de butila
- B.
propanoato de metila
- C.
butanoato de hexila
- D.
butanoato de etila
- E.
etanoato de propila
Apesar da relação direta com os metais, o fenômeno da corrosão ocorre, também, com outros materiais como concreto e polímeros orgânicos. Sobre corrosão, considere as afirmativas a seguir.
I - A água do mar é considerada um meio corrosivo, e o solo é considerado um meio inerte, não corrosivo.
II - A corrosão do ferro é um processo espontâneo e representa a tendência de formação de um produto mais estável.
III - A proteção catódica é uma escolha adequada para revestir superfícies metálicas passíveis de corrosão.
Está correto APENAS o que se afirma em
- A.
I
- B.
II
- C.
III
- D.
I e II
- E.
II e III
Estruturas metálicas feitas com aço (liga de ferro e carbono) costumam deteriorar-se com o passar do tempo. Para diminuir esse desgaste, é comum aplicar uma camada protetora contendo outro metal sobre a superfície do aço, que agirá como metal de sacrifício protegendo a liga. Esse metal de sacrifício
- A.
pode ser a platina por ser um metal nobre.
- B.
oxida-se dificilmente em presença de oxigênio e umidade.
- C.
permanece inalterado, ou seja, não se desgasta nunca.
- D.
é um agente mais redutor que o ferro.
- E.
é chamado de catodo de sacrifício.
Na determinação de cobre em uma amostra, utilizou-se a potenciometria com um sistema que consiste em um eletrodo de referência de calomelano e um eletrodo de trabalho que detecta a mudança na atividade dos íons Cu2+ na solução. Verificou-se que a matriz da amostra causou a diminuição significativa de sinal analítico do cobre em relação ao observado na medição em um padrão aquoso de calibração de mesma concentração. Propõem-se três estratégias para realizar essa determinação com exatidão:
I - Interpolar o sinal do analito medido diretamente na amostra, numa curva de calibração feita com padrões aquosos de Cu2+.
II - Extrair totalmente os íons Cu2+ em coluna de troca iônica e, depois, eluir todo o analito em meio aquoso para separá-lo dos componentes da matriz e usar interpolação do sinal do analito numa curva de calibração com padrões aquosos de Cu2+.
III - Separar o íon Cu2+ em clorofórmio (extração líquidolíquido) e interpolar o sinal analítico numa curva de calibração feita com padrões de Cu2+ preparados em clorofórmio.
Proporcionariam um resultado exato APENAS as estratégias propostas em
- A.
I
- B.
II
- C.
III
- D.
I e II
- E.
II e III
Os sistemas potenciométricos precisam de pelo menos um eletrodo de referência para a obtenção de medidas de potencial consistentes no eletrodo de trabalho. Dentre os eletrodos que devem ser usados como referência, NÃO se inclui o eletrodo
- A.
saturado de calomelano: Hg | Hg2Cl2(s) | KCl(sat)
- B.
padrão de hidrogênio: Pt | H2(g) (1 atm) | H+ (aq)
- C.
de prata-cloreto de prata: Ag | AgCl(s) | KCl(sat)
- D.
de talamida: Tl(amálgama a 40%) | TlCl(s) | KCl(sat)
- E.
de fio de platina: Pt
Em uma separação de duas substâncias por cromatografia de camada fina, utilizaram-se uma placa recoberta com uma camada de alumina e, como fase móvel, hexano. Após certo tempo na câmara de desenvolvimento, a linha frente do hexano atingiu 5,0 cm, com os centros das manchas das duas substâncias separadas percorrendo respectivamente 2,5 e 4,0 cm. O valor mais aproximado para o Rf da substância mais polar é
- A.
0,5
- B.
0,6
- C.
0,8
- D.
1,3
- E.
2,0
A cromatografia líquida com fase reversa faz uso de uma fase estacionária apolar e de uma fase móvel polar. Esse tipo de cromatografia pode ser usado para separar
- A.
grandes moléculas, como as proteínas, em função da diferença nos seus tamanhos.
- B.
cátions inorgânicos que são trocados por outros, característicos da estrutura da coluna.
- C.
substâncias orgânicas que formam diferentes coeficientes de partição entre fase móvel e fase estacionária.
- D.
substâncias com diferentes graus de solubilidade na fase móvel, que se precipitarão seletivamente na fase estacionária.
- E.
íons, em função de diferentes capacidades de migração na fase móvel onde se aplica uma diferença de potencial elétrico.
Um técnico recebeu a incumbência de neutralizar uma solução de ácido sulfúrico com solução de hidróxido de sódio. Como não dispunha da solução de hidróxido de sódio, substituiu-a por outra da mesma função química. A solução utilizada pelo técnico foi
- A.
CO2
- B.
HCl
- C.
NH4Cl
- D.
HC2H3O2
- E.
Ca(OH)2

- A.
v = K.[A].[B]
- B.
v = K.[A]2.[B]
- C.
v = K.[A].[B]2
- D.
v = K.[A]2.[B]3
- E.
v = K.[A]3.[B]2

- A.
aumento do valor de Ka
- B.
aumento da concentração de H3O+
- C.
aumento da concentração de C2H3O2 −
- D.
aumento da concentração de HC2H3O2
- E.
diminuição do valor de pH


