Questões de Química do ano 2011
Lista completa de Questões de Química do ano 2011 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Um tanque, inicialmente sob vácuo, é preenchido com um gás proveniente de uma linha com pressão constante. Desprezando-se a transferência de calor entre o gás e o tanque e as variações de energia cinética e potencial, a relação entre a entalpia específica do gás na linha de entrada (HE) e a energia interna específica do gás no interior do tanque, após o enchimento (U), é
- A.

- B.

- C.

- D.

- E.

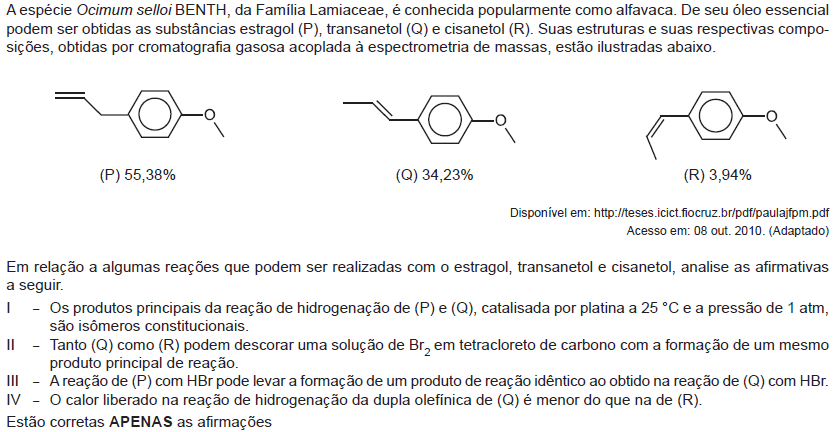
- A.
I e IV.
- B.
II e III.
- C.
III e IV.
- D.
I, II, e III.
- E.
I, II e IV.
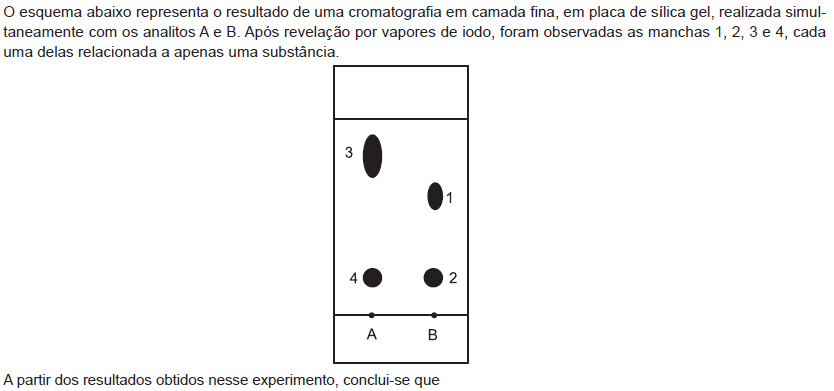
- A.
a substância 3 é a menos polar dentre as substâncias 1, 2, 3 e 4.
- B.
a substância 3 possui o menor Rf dos quatro componentes separados.
- C.
as substâncias 1 e 3 possuem a mesma polaridade.
- D.
as substâncias 2 e 4 são idênticas.
- E.
o eluente escolhido é inadequado para separar as substâncias 1 e 2, presentes no analito B.
A utlização do eletrodo de Ag/AgCl pode ser tanto como eletrodo de referência quanto como eletrodo indicador.
PORQUE
O eletrodo Ag/AgCl tem um potencial conhecido, que é essencialmente constante e insensível à composição das soluções de estudo, sendo, ainda, construído com base em uma reação reversível; obedece à Equação de Nerst, pode retornar ao seu potencial original após ser submetido a pequenas correntes e exibe baixa histerese sob ciclos de temperatura. A esse respeito, conclui-se que
- A.
as duas afirmações são verdadeiras, e a segunda justifica a primeira.
- B.
as duas afirmações são verdadeiras, e a segunda não justifica a primeira.
- C.
a primeira afirmação é verdadeira, e a segunda é falsa.
- D.
a primeira afirmação é falsa, e a segunda é verdadeira.
- E.
as duas afirmações são falsas.
Uma solução de uma dada amostra apresenta absortividade de 200 Lmol1cm1. Foi analisada por espectroscopia na região do UV/Vis em um comprimento de onda na qual se obedece à lei Lambert Beer na concentração empregada nesse experimento. Considere que o caminho óptico é de 1 mm, e a absorbância observada é 0,4. Empregando esse resultado na equação de Lambert-Beer, conclui-se que a concentração da amostra é, aproximadamente,
- A.
0,01 molL1
- B.
0,02 molL1
- C.
0,002 molL1
- D.
8,0 molL1
- E.
80 molL1
Para se determinar o teor de cloreto em 1 litro de uma solução salina pelo método de Volhard, retirou-se uma alíquota de 25 mL da mesma, que foi tratada com 40 mL de uma solução padrão de nitrato de prata com concentração 0,150 M. Após a precipitação quantitativa do cloreto na forma de AgCl, titulou-se o excesso de prata remanescente com uma solução padrão de KSCN 0,200 M, contendo íons Fe3+ como indicador. O volume de titulante gasto para se atingir o ponto de equivalência foi de 5 mL. Com base nesses dados, conclui-se que a massa de cloro presente na forma de cloreto na solução inicial é, aproximadamente, de
- A.
0,2 g
- B.
1,0 g
- C.
5,0 g
- D.
6,0 g
- E.
7,0 g
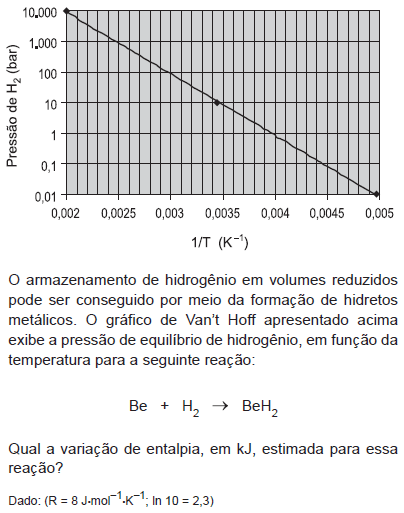
- A.
37
- B.
20
- C.
0
- D.
35
- E.
47
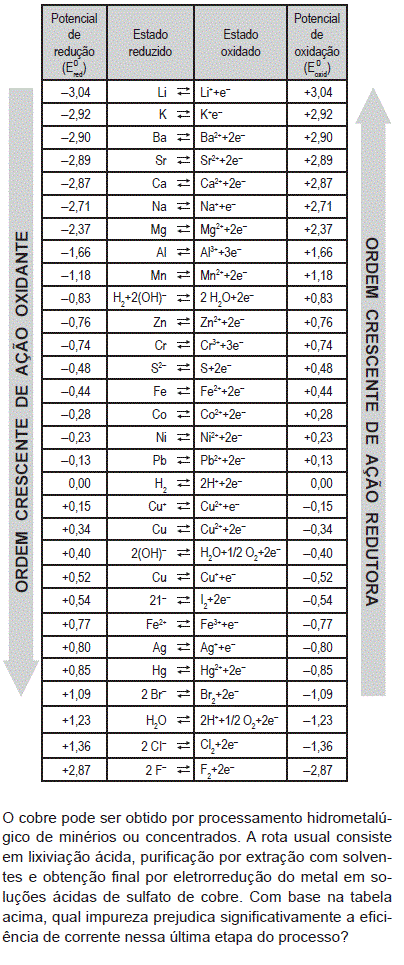
- A.
Mn
- B.
Cr
- C.
Co
- D.
Fe
- E.
F

- A.
20
- B.
32
- C.
40
- D.
64
- E.
100
A combinação das Leis de Boyle, de Charles e de Avogadro gerou a Lei dos Gases Ideais, representada pela expressão PV = nRT. Essa é uma equação de estado que descreve a resposta de um gás ideal a mudanças de pressão, volume, temperatura e quantidade de moléculas. Entretanto, vários processos industriais e pesquisas em laboratório usam gases sob alta pressão ou em condições muito baixas de temperatura, condições às quais as leis dos gases ideais não são exatamente obedecidas. Nesses casos, o comportamento se assemelha ao dos gases reais. Em relação à teoria dos gases reais e ideais, afirma-se que
- A.
em uma quantidade fixa de gás em temperatura constante, o volume é diretamente proporcional à pressão, segundo a Lei de Boyle.
- B.
o volume de uma quantidade fixa de gás sob pressão constante varia inversamente com a temperatura, segundo a Lei de Charles.
- C.
o volume ocupado por uma amostra de gás sob pressão e temperatura constantes é inversamente proporcional ao número de mols de moléculas presentes, segundo o Princípio de Avogadro.
- D.
a equação do virial é uma equação geral usada para descrever gases reais e leva em consideração as forças de atração e de repulsão intermoleculares.
- E.
a equação de van der Waals é uma equação de estado aproximada de um gás real que, independente da temperatura, inclui parâmetros relacionados somente com as forças de atração.


