Questões de Química do ano 2012
Lista completa de Questões de Química do ano 2012 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
A neutralização de uma solução ácida pode ser realizada pela adição de materiais com propriedades alcalinas, como
- A.
sal de cozinha e detergente.
- B.
sal de cozinha e vinagre.
- C.
fermento químico e amoníaco.
- D.
detergente e vinagre.
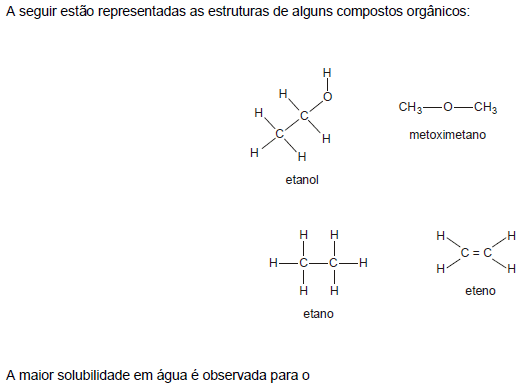
- A.
etanol.
- B.
metoximetano.
- C.
etano.
- D.
eteno.
Átomos de mesmo elemento que ganham estabilidade ao perder elétrons tendem a se unir entre si por ligação
- A.
metálica, devido à transferência dos elétrons de um átomo para outro.
- B.
covalente, devido à transferência dos elétrons de um átomo para outro.
- C.
iônica, devido à transferência dos elétrons de um átomo para outro.
- D.
metálica, devido à atração do núcleo de um átomo pela eletrosfera dos átomos vizinhos.
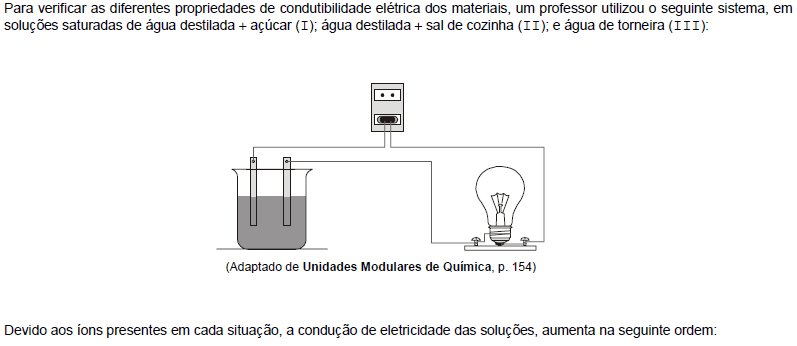
- A.
II, III e I.
- B.
II, I e III.
- C.
I, III e II.
- D.
III, II e I.
A sacarose, ou açúcar comum, se dissolve facilmente em água porque
- A.
as ligações covalentes da estrutura desse açúcar são rompidas pela água.
- B.
os grupos OH desse açúcar formam ligações de hidrogênio com a água.
- C.
os íons desse açúcar ficam dispersos na água.
- D.
esse açúcar e a água são estruturas apolares.
Uma reação com catalisador é mais rápida em relação à mesma reação sem catalisador porque
- A.
a energia de ativação da etapa mais lenta é menor.
- B.
o caminho da reação é menor.
- C.
o complexo ativado se forma em etapas exotérmicas.
- D.
a reação de endotérmica passa a ser exotérmica.

- A.
o zinco metálico sofra oxidação.
- B.
a tensão elétrica da célula galvânica formada seja 5,34 V.
- C.
o eletrodo de lítio seja o cátodo da célula galvânica.
- D.
os elétrons fluam do Li (s) para o Zn (s).
Considere um composto do tipo MX, onde M é um metal alcalino e X é um halogênio, pertencentes ao 2º período da Tabela Periódica. Esse composto
- A.
é molecular e não conduz corrente elétrica no estado líquido.
- B.
apresenta temperatura de fusão e de ebulição menores do que a água.
- C.
é iônico e bom condutor de eletricidade no estado líquido.
- D.
é formado por moléculas e existem forças covalentes bastante intensas entre seus átomos.
O iodo é um sólido cristalino, cinza, brilhante. No aquecimento de seus cristais, origina-se um gás violeta. A mudança de estado físico descrita para o iodo é
- A.
vaporização.
- B.
vaporização.
- C.
condensação.
- D.
fusão.
Um litro de solução de ácido perclórico, HClO4, de pH = 2,0, foi diluído com água até o dobro do volume inicial. O pH da nova solução
Dados:
log 5 = 0,7
log 2 = 0,3
- A.
aumentou em uma unidade de pH.
- B.
diminuiu em 0,7 unidade de pH.
- C.
diminuiu em 0,5 unidade de pH.
- D.
aumentou em 0,3 unidade de pH.


