Questões de Química do ano 2012
Lista completa de Questões de Química do ano 2012 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
A separação de misturas heterogêneas sólido-líquido e a trituração de sólidos são conseguidas corretamente com utilização de, respectivamente,
- A.
centrífuga e almofariz.
- B.
proveta e pipeta graduada.
- C.
funil de filtração e cadinho.
- D.
funil de decantação e almofariz.
São exemplos de transformações químicas:
- A.
formação de orvalho, formação da ferrugem, cozimento dos alimentos.
- B.
sublimação do iodo, fusão do enxofre, amadurecimento de uma fruta.
- C.
aquecimento de um fio de platina, queima de uma fita de magnésio, pulverização do sal de cozinha.
- D.
queima de uma fita de magnésio, amadurecimento de uma fruta, cozimento dos alimentos.

- A.
0,1; 0,2; 0,3.
- B.
0,1; 0,1; 0,5.
- C.
0,1; 0,2; 0,5.
- D.
0,2; 0,2; 0,5.
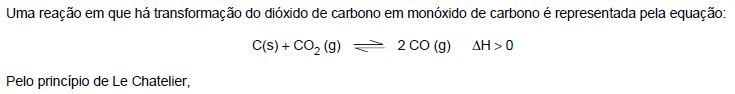
- A.
a adição de carbono desloca o equilíbrio para o sentido do produto.
- B.
o aumento da temperatura desloca o equilíbrio para o sentido do produto.
- C.
o aumento da pressão desloca o equilíbrio para o sentido do produto.
- D.
a adição de um catalisador desloca o equilíbrio para o sentido dos reagentes.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação Carlos Chagas (FCC) - 2012
O nuclídeo formado após a emissão de uma partícula alfa por um nuclídeo de número atômico 92 e número de massa 238 possui número atômico
- A.
88 e número de massa 236.
- B.
92 e número de massa 237.
- C.
90 e número de massa 234.
- D.
91 e número de massa 238.
Como consequência das queimadas, há consumo e liberação, respectivamente, de
- A.
gás carbônico e oxigênio.
- B.
oxigênio e vapor de água.
- C.
vapor de água e gás carbônico.
- D.
vapor de água e oxigênio.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação Carlos Chagas (FCC) - 2012
A porcentagem em massa de ferro, no cloreto ferroso, é, aproximadamente,
Dados:
Massa molar (g/mol):
Fe = 56
Cl = 35,5
- A.
44%.
- B.
34%.
- C.
55%.
- D.
60%.
A água deionizada ou desmineralizada utilizada nos laboratórios é inadequada para o consumo humano porque
- A.
é contaminada com coliformes e outros micro-organismos.
- B.
pode provocar carências iônicas e desmineralização no organismo.
- C.
possui condutividade elétrica maior que a da água destilada.
- D.
possui pH maior que o da água destilada.
Uma solução contém íons zinco, Zn2+ (aq), em concentração 0,01 mol/L. Para que a solução fique saturada a 25 °C, sem precipitado de ZnS (s), a concentração do ânion sulfeto, S2- (aq), deve ser igual a
Dado:
Kps do ZnS, a 25 °C = 1,6 × 10−24
- A.
1,6 × 10−18.
- B.
3,2 × 10−20.
- C.
1,6 × 10−22.
- D.
3,2 × 10−24.
William Justin Kroll, em 1946, mostrou que o titânio podia ser obtido comercialmente pela redução do TiCl4 com magnésio metálico. No processo Kroll, representado pela equação de óxido-redução não balanceada
TiCl4 + Mg → MgCl2 + Ti
- A.
a soma dos menores coeficientes inteiros da equação balanceada é igual a 12.
- B.
o magnésio é o agente oxidante.
- C.
o titânio é o agente redutor.
- D.
o número de oxidação do titânio varia de +4 para zero.


