Questões de Química do ano 2013
Lista completa de Questões de Química do ano 2013 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
Sobre as propriedades químicas dos compostos orgânicos oxigenados, afirma-se que _____________ são oxidados por agentes oxidantes fortes resultando em _____________.
As lacunas do texto são preenchidas, correta e respectivamente, por:- A.
aldeídos éteres
- B.
álcoois primários esteres
- C.
álcoois secundários cetonas
- D.
álcoois terciários aldeído
- E.
ésteres aldeídos.
Química - Reações, Soluções e Transformações Químicas - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
Nas reações orgânicas pode ocorrer a formação de grupos intermediários instáveis nos quais o átomo de carbono não apresenta quatro ligações. Esses grupos se originam da ruptura de ligações entre átomos, que pode ocorrer de forma homogênea ou heterogênea. Denomina-se ruptura ______________ quando a ligação entre átomos com ______________ eletronegatividade se rompe e origina ______________ .
As lacunas do texto são preenchidas, correta e respectivamente, por:- A.
homolítica iguais radicais livres
- B.
homolítica iguais carbocátions ou carbânion
- C.
homolítica diferentes radicais livres
- D.
heterolítica iguais carbocátion ou carbânion
- E.
heterolítica diferentes radicais livres
Química - Química Inorgânica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
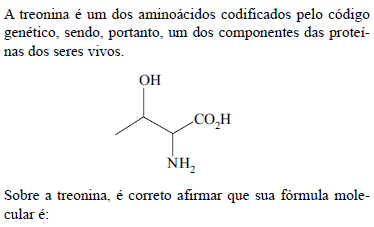
- A.
C3H7O3N; é uma molécula aquiral e tem dois isômeros ópticos.
- B.
C3H7O3N; é uma molécula quiral e tem dois isômeros ópticos.
- C.
C4H9O3N; é uma molécula quiral e tem dois isômeros ópticos.
- D.
C4H9O3N; é uma molécula aquiral e tem quatro isômeros ópticos.
- E.
C4H9O3N; é uma molécula quiral e tem quatro isômeros ópticos.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
No estudo da alotropia, um exemplo clássico é o caso dos alótropos naturais do carbono, pois, sem dúvida alguma, apresentam as diferenças de propriedades físicas mais pronunciadas entre os alótropos que ocorrem na natureza. Uma forma de explicar as diferentes propriedades desses alótropos está baseada no conjunto de orbitais híbridos que formam as ligações nos átomos de carbono.
O _____________ apresenta hibridização _____________ que resulta em uma estrutura cúbica modificada, em que cada átomo de carbono está ligado a outros átomos de carbono com ângulos de ligações idênticos e de aproximadamente 109,5º.
O _____________ apresenta hibridização _____________ , que resulta em estrutura planar, em que cada átomo de carbono está ligado a outros átomos de carbono com ângulo de ligação de 120º. Nessa estrutura, também se forma uma ligação π deslocalizada ao longo de todo plano de ligação.
As lacunas do texto são, preenchidas, correta e respectivamente, por:
- A.
diamante sp2 grafite sp3
- B.
diamante sp3 grafite sp2
- C.
diamante sp grafite sp3
- D.
grafite sp diamante sp2
- E.
grafite sp2 diamante sp3
Química - Reações, Soluções e Transformações Químicas - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013

- A.
não é espontânea em qualquer faixa de temperatura.
- B.
é espontânea independente da faixa de temperatura.
- C.
é espontânea se |TΔS|> ΔH.
- D.
é espontânea se |TΔS|< ΔH.
- E.
é espontânea se |TS|= ΔH.
Química - Termoquímica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013

- A.
553.
- B.
- 703.
- C.
1361.
- D.
+ 553.
- E.
+ 1375.
Química - Reações, Soluções e Transformações Químicas - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
Foram preparadas separadamente, usando água purificada por destilação e por troca iônica (pH =7), soluções 1,0 mol . L 1 de
Acetato de sódio;
Oxalato de potássio;
Carbonato de sódio;
Nitrato de amônio;
Cloreto de alumínio.
Medindo-se seus valores de pH a 25 ºC, verifica-se corretamente que apresentam valores de pH < 7 as soluções de
- A.
acetato de sódio e carbonato de sódio.
- B.
acetato de sódio e oxalato de potássio.
- C.
cloreto de alumínio e carbonato de sódio.
- D.
nitrato de amônio oxalato de potássio.
- E.
nitrato de amônio e cloreto de alumínio.
Química - Práticas Laboratoriais em química - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
A piridina é empregada em métodos analíticos devido à sua propriedade complexante de metais. Uma amostra de um branco de análise espectrofotométrica foi preparada adicionando-se 0,7 905 g de piridina (C5H5N) em um balão volumétrico com capacidade de 100 mL, completando-se o volume com água a 25 ºC (pH = 7,0) purificada por processo de destilação e deionização. O pH da solução de piridina preparada é igual a
Dado: Constante de basicidade da piridina a 25 ºC, Kb ≅ 1 x 10 9
- A.
3.
- B.
5.
- C.
9.
- D.
10.
- E.
11.
Química - Práticas Laboratoriais em química - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
Em uma indústria de galvanoplastia, houve um grande aumento de demanda. Após a instalação de mais cubas para eletrodeposição, verificou-se que o tempo total de operação precisava ser diminuído sem prejudicar a qualidade do produto final. O operador do banho de decapagem química (com ácido clorídrico) feita nas peças de aço enviou um relatório sugerindo algumas medidas para diminuir o tempo necessário para a decapagem, mantendo-se o processo dentro dos parâmetros de segurança:
I. Aumento da temperatura do banho de decapagem.
II. Aumento da concentração da solução de ácido clorídrico.
III. Troca do ácido clorídrico por ácido fosfórico.
O responsável técnico pela galvanoplastia analisou as sugestões e, atribuindo a cada uma das propostas (I, II e III) a classificação de válida (V) ou inválida (I) para a finalidade de diminuição do tempo de decapagem; classificou-as, correta e respectivamente, como
- A.
V, I, V.
- B.
V, V, I.
- C.
I, V, V.
- D.
I, I, V.
- E.
I, V, I.
Química - Química Inorgânica - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013
As ligações químicas nos compostos SF6 e BF3 são corretamente representadas empregando-se para os átomos centrais dessas moléculas, respectivamente, os conjuntos de orbitais híbridos
- A.
sp3 e sp.
- B.
sp3 e sp2.
- C.
sp3d e sp3.
- D.
sp3d2 e sp.
- E.
sp3d2 e sp2.


