Questões de Química do ano 2016
Lista completa de Questões de Química do ano 2016 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Uma das etapas do tratamento de água envolve a retirada de impurezas coloidais que não sedimentam com facilidade. Essa etapa do processo ocorre em misturadores adequados, nos quais são adicionadas à água substâncias químicas que promovem a formação de flocos coloidais. Em seguida, a água é conduzida para tanques e o processo de tratamento prossegue.
A operação de separação que ocorre nesses tanques é denominada
- A. dessalinização.
- B. decantação.
- C. coagulação.
- D. oxidação.
- E. aeração.
Entre os parâmetros utilizados nas estações de tratamento de água para avaliar os mananciais estão a turbidez e os resíduos sólidos. Estes parâmetros estão relacionados e podem reduzir a penetração de luz no corpo dágua, influenciando na temperatura e no aporte de substâncias, prejudicando toda a biota.
Os métodos analíticos que podem ser utilizados para avaliar turbidez e os resíduos sólidos são, respectivamente,
- A. nefelométrico e gravimétrico.
- B. nefelométrico e granulométrico.
- C. granulométrico e potenciométrico.
- D. colorimétrico e gravimétrico.
- E. potenciométrico e colorimétrico.
O tratamento convencional da água inclui os processos de coagulação, floculação, filtração, desinfecção, ajuste do pH e fluoretação. Nas etapas do tratamento da água podem ser utilizados os produtos químicos permanganato de potássio, cloreto de ferro (III), sulfato de ferro (III), carbonato de sódio e hipoclorito de sódio.
Estes produtos são adequadamente utilizados nos processos
- A. permanganato de potássio - ajuste do pH.
- B. cloreto de ferro (III) desinfecção.
- C. sulfato de ferro (III) coagulação.
- D. carbonato de sódio filtração.
- E. hipoclorito de sódio floculação.
Os sais de nitrato são compostos iônicos muito solúveis em água. Quando se coloca 1 mol de nitrato de cálcio em 1 litro de água ocorre a formação de uma solução na qual os íons estão separados e solvatados por moléculas de água.
Nessa solução, as concentrações em mol.L-1 dos íons cálcio e nitrato, presentes na solução são, respectivamente,
- A. 1 e 1.
- B. 1 e 2.
- C. 2 e 3.
- D. 3 e 2.
- E. 2 e 4.
Na preparação de uma curva de calibração para analisar nitrato em amostras de água por meio da técnica de cromatografia iônica, um analista utilizou uma solução padrão de concentração inicial 99,6 mg.L1 e preparou diferentes volumes de soluções com diferentes concentrações. A tabela a seguir apresenta volumes utilizados da solução padrão e concentrações das soluções preparadas.

Os maiores volumes (em mL) preparados foram os correspondentes às soluções
- A. 1, 2 e 3, apenas.
- B. 1, 3 e 4, apenas.
- C. 3 e 4, apenas.
- D. 5 e 6, apenas.
- E. 2 e 6, apenas.
Para determinar a concentração de ortofosfato em uma amostra foi utilizado o método do ácido ascórbico. Nesse método, o ácido ascórbico reage com o ortofosfato, na presença de molibdato de amônio e de antimonil tartarato de potássio em meio ácido, formando o ácido fosfomolíbdico, que será reduzido formando azul de molibdênio. A intensidade da coloração da substância observada em espectofotômetro em comprimento de onda 880 nm indica a concentração de ortofostato. A curva de calibração a seguir foi obtida utilizando o método do ácido ascórbico para amostras padrões de ortofosfato.

Uma amostra desconhecida contendo ortofosfato apresentou absorvância 0,090 ua seguindo as mesmas condições de análise. A concentração de ortofosfato, em mg.L-1, nessa amostra é de, aproximadamente,
- A. 0,055.
- B. 0,065.
- C. 0,136.
- D. 0,187.
- E. 0,233.
A piretrina e a aletrina, cujas estruturas estão representadas a seguir, são inseticidas naturais muito utilizados no controle de pragas agrícolas, antes da Segunda Guerra Mundial.

Hoje, esses e outros compostos naturais inspiram a busca por biopesticidas, substâncias produzidas pela natureza que são capazes de atuar no controle de pragas. O objetivo é que os biopesticidas, que causam menos danos ao ecossistema, substituam paulatinamente os inseticidas sintéticos.
As cadeias carbônicas da piretrina e da aletrina possuem
- A. dois anéis heterocíclicos.
- B. a mesma fórmula molecular.
- C. as mesmas funções orgânicas.
- D. o mesmo número de ligações do tipo sigma.
- E. o mesmo número de carbonos com geometria trigonal.
Em 1923, o químico dinamarquês Johannes Brønsted (1879-1947) e o químico inglês Thomas Lowry (1874-1936) propuseram uma definição de ácidos e bases mais geral do que a proposta anteriormente por Arrhenius (1859-1927). O conceito de Brønsted- Lowry está baseado no fato de que a reação ácido-base envolve transferência de íons H+ de uma substância para outra.

- A.

- B.

- C.

- D.

- E.

A amônia atmosférica é de fundamental importância para a química ambiental, pois se trata de um composto capaz de neutralizar, em determinada extensão, gases ácidos e espécies ácidas adsorvidas em partículas.
Em uma determinada temperatura, a amônia apresenta pKb= 5. Nessas condições uma solução 0,1mol.L1 de amônia apresentará valor de pH igual a Dado: pKw = 14
- A. 3
- B. 8
- C. 10
- D. 11
- E. 13
Uma mistura gasosa de 10 mmol de CO e 10 mmol de H2O é colocada em um reator de 500 mL e aquecida até 500 °C, atingindo o equilíbrio:
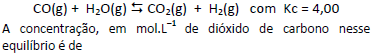
- A. 5,00 x 103.
- B. 1,33 x 102.
- C. 3,67 x 102.
- D. 4,00 x 102.
- E. 5,25 x 102.


