Questões sobre Reações, Soluções e Transformações Químicas
Lista completa de Questões sobre Reações, Soluções e Transformações Químicas para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2008
Se 40 gramas de hidróxido de sódio são dissolvidos em 162 g de água, a quente, a fração molar do soluto será:
- A.
0,2;
- B.
0,02;
- C.
0,1;
- D.
0,01;
- E.
0,5.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
As aplicações forenses da espectroscopia UV-VIS incluem a análise de narcóticos e os testes para drogas. No teste do bafômetro, por exemplo, a quantidade de álcool no sangue pode ser determinada borbulhando-se o ar da respiração em uma solução acidificada de K 2 Cr 2 O 7 . O etanol presente na respiração é oxidado pelo dicromato, produzindo ácido acético e Cr 3+ . A concentração de etanol na amostra de respiração é determinada com base na diminuição da concentração do íon dicromato na solução que pode ser monitorada pela diminuição da absorvância a 440 nm.
Com base nessas informações, julgue os itens seguintes.
A conversão de etanol a ácido acético é uma oxidação branda.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2008
Das reações a seguir, indique a que é uma reação de óxi-redução:
- A.

- B.

- C.

- D.

- E.

Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2008
Para a formação da ligação, duas condições são necessárias: um par de elétrons com spins opostos e um orbital estável em cada átomo. A força de ligação é quantitativamente proporcional à interpenetração das nuvens de carga dos dois átomos.
O texto refere-se à ligação:- A.
iônica;
- B.
metálica;
- C.
covalente;
- D.
por forças de Van der Waals;
- E.
por pontes de hidrogênio.
Deseja-se padronizar uma solução de KMnO4 frente a uma solução padrão de Na2C2O4 0,1 N. Para tal, foram titulados cuidadosamente 25,00mL da solução padrão de Na2C2O4 0,1 N, acrescidos de 40,0mL de solução de H2SO4 6N, com a solução de KMnO4, mantendo-se a mistura aquecida a uma temperatura entre 50 e 60 °C, até o aparecimento de uma coloração levemente rosada, que persiste mesmo sob forte agitação. A titulação foi repetida com mais duas alíquotas da solução de Na2C2O4. Os volumes de solução de KMnO4 consumidos, já corrigidos em relação ao ensaio em branco, foram respectivamente: 22,10; 22,20 e 22,15. A respeito desse procedimento, pode-se afirmar que:
I - a concentração da solução de KMnO4 é de 0,1128 N;
II - trata-se de uma análise volumétrica por oxi-redução;
III - não foi necessário o uso de indicador, pois em meio fortemente ácido o íon MnO4 - (forma oxidada) é violeta e a forma reduzida (Mn ++)4 é incolor.
Está(ão) correta(s) a(s) afirmativa(s)
- A.
I, apenas.
- B.
I e II, apenas.
- C.
I e III, apenas.
- D.
II e III, apenas.
- E.
I, II e III.
Considere as seguintes informações sobre as substâncias X, Y e Z, que foram obtidas a 25 °C e 1 atm:
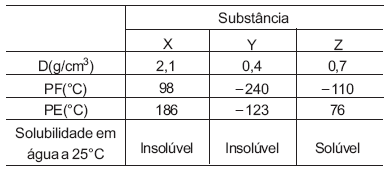
Analisando-se os dados da tabela, pode-se afirmar que:
I - o estado físico da substância Y é líquido, a temperatura ambiente;
II - a substância que apresenta menor pressão de vapor, a temperatura ambiente, é X;
III - o processo mais adequado para separar uma mistura da substância Z com a água, a temperatura ambiente, é a filtração;
IV- uma mistura das substâncias X , Z e água forma um sistema bifásico.
Estão corretas APENAS as afirmativas
- A.
I e II
- B.
I e IV
- C.
II e III
- D.
II e IV
- E.
I, II e III
Em que proporção deve-se diluir uma solução de NaOH, de concentração 60g/l, para transformá-la em solução de concentração 0,05 molar? (Dados: H = 1; O = 16; Na = 23)
- A.
10 vezes
- B.
20 vezes
- C.
30 vezes
- D.
40 vezes
- E.
Depende do volume inicial da solução
A partir da calcinação de 80g de um mármore foram obtidos 42g de óxido de cálcio. Qual o grau de pureza do mármore?
- A.
99,5%
- B.
93,75%
- C.
89,6%
- D.
76,7%
- E.
72,7%
1,55g de ácido bórico impuro (H3BO3) foram dissolvidos em água suficiente para 25mL de solução. Em seguida, foi retirada a alíquota de 25mL, cuja titulação consumiu 20mL de hidróxido de potássio 0,25N. Admitindo que as impurezas não reagiram, qual a pureza do ácido bórico utilizado? (Dados: MAH=1, MAB=11 e MAO=16)
- A.
43,6%
- B.
57,7%
- C.
66,4%
- D.
72,2%
- E.
87,5%
As variações de entalpias de formação de dois óxidos de ferro são:
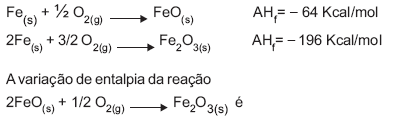
- A.
+ 132 Kcal/mol de Fe2SO3
- B.
+ 68 Kcal/mol de Fe2SO3
- C.
- 68 Kcal/mol de Fe2SO
- D.
- 132 Kcal/mol de Fe2SO3
- E.
- 260 Kcal/mol de Fe2SO3


