Questões sobre Reações, Soluções e Transformações Químicas
Lista completa de Questões sobre Reações, Soluções e Transformações Químicas para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Considerando-se que um determinado GLP, Gás Liquefeito de Petróleo, ou gás de cozinha, é composto em 100% de gás butano e foi comercializado em botijões com peso líquido de 13 kg, qual a quantidade de O2 , em kg de O2, necessária para a combustão completa do gás contido em um botijão?
Dados: ( Massa atômica em g/mol, C=12; H=1; O=16 )- A. 13,0
- B. 32,1
- C. 36,5
- D. 46,6
- E. 52,4

- A.

- B.

- C.

- D.

- E.

De acordo com as características químicas dos ácidos HCl e CH3COOH, NÃO é correto afirmar que
- A. o HCl é um ácido forte.
- B. o CH3COOH é um ácido fraco.
- C. a solução 1M de HCl tem uma concentração instantânea de íons de hidrogênio muito maior do que a solução 1M de CH3COOH.
- D. uma solução 1M de HCl tem uma capacidade muito maior do que uma solução 1M de CH3COOH para neutralizar uma solução básica.
- E. tanto o HCl quanto o CH3COOH têm um átomo de hidrogênio ácido por molécula.
O modelo da repulsão dos pares de elétrons da camada de valência (VSPER) amplia a teoria da ligação química de Lewis para explicar as formas das moléculas. De acordo com essa teoria, assinale a alternativa correta, considerando os seguintes números atômicos: H = 1; Be = 4; C = 6; F = 9; P = 15; Cl = 17; e I = 53.
- A.
A geometria da molécula do pentacloreto de fósforo é bipirâmide trigonal.
- B.
Na molécula do C3H4 (aleno), pode ser atribuída aos átomos de carbono a hibridação sp2.
- C.
Pode-se atribuir a hibridação sp3 ao átomo de enxofre na molécula do SF4.
- D.
O íon IF4 - não é planar.
- E.
A hibridação do átomo de berílio, na molécula do dimetilberílio, é sp2
A formação de ligações químicas com diferentes arranjos resulta na possibilidade de formação de milhares de compostos diferentes. Dessa forma, as ligações químicas são fundamentais para a química e para o entendimento das reações químicas. Assinale a alternativa que apresenta correlação adequada entre a interação apontada e a respectiva ligação química preponderante.
- A.
Interação entre átomos de mercúrio (Hg) no estado líquido → ligação iônica.
- B.
Interação entre moléculas de água (H2O) no estado líquido → ligação iônica.
- C.
Interação entre átomos de carbono (C) na forma de grafite → ligação covalente.
- D.
Interação entre íons sódio (Na+) e cloreto (Cl-) no estado sólido → ligação covalente.
- E.
Interação entre moléculas de hidrogênio (H2) no estado gasoso → ligação de hidrogênio.
O ácido oxálico (etanodioico) é usado em lavanderias comerciais e na remoção de ferrugem e de depósitos em radiadores de automóveis. Esses usos são consequência da capacidade do ácido oxálico de formar complexos solúveis com os íons ferro. Essa propriedade também o torna bastante venenoso. O nome deriva do grego oxalis, que significa ácido, e do gênero de algumas plantas herbáceas. Os cálculos renais, por exemplo, são formados por depósitos de oxalato de cálcio, na forma de pequenos cristais que não se dissolvem. As figuras seguintes representam, respectivamente, as fórmulas da molécula de ácido oxálico e do composto oxalato de cálcio.
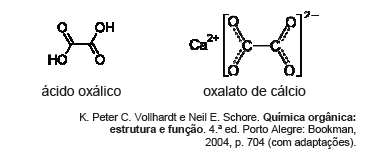
Avaliando as afinidades químicas dos compostos apresentados no texto VI, é possível delinear relações quantitativas envolvidas em determinadas reações. Entre essas reações, está a de formação de oxalato de cálcio, a partir de ácido oxálico e hidróxido de cálcio. Considerando uma amostra de 150 mL de solução de ácido oxálico na concentração de 0,05 mol L1, o volume de solução de hidróxido de cálcio a 0,2 mol L1 necessário para converter todo o ácido oxálico dessa amostra em oxalato de cálcio é igual a
- A.
7,5 mL.
- B.
37,5 mL.
- C.
75,0 mL.
- D.
150,0 mL.
- E.
600,0 mL.
Um reservatório de água foi contaminado com estireno, um hidrocarboneto aromático de alta toxicidade. Após um tratamento para a remoção deste contaminante, uma amostra de 20 mL desta água foi submetida a um procedimento para avaliação do teor residual de benzeno. Essa amostra foi extraída com 10 mL de um solvente orgânico transparente à radiação UV-Vis; em seguida, 3 mL desta fase orgânica da extração foram analisados em espectrofotômetro de UV-Vis a 244 nm em uma cubeta de quartzo de 1 cm de passo ótico, fornecendo um valor de absorvância igual a 0,12 uA. Sabendo-se que o valor de absortividade molar do estireno a 244 nm é igual a 12.000, e a massa molar do estireno é igual a 104, conclui-se que o teor residual deste composto na água é igual a
- A.
0,01 mg/L
- B.
0,03 mg/L
- C.
1,04 mg/L
- D.
1,04 g/L
- E.
3,12 g/L
Catalisadores são compostos adicionados a um processo químico, mas que não são consumidos durante o processo, embora afetem sua cinética. Assim, os catalisadores
- A.
alteram a cinética de uma reação, deslocando o equilíbrio no sentido da formação dos produtos e, por isso, aumentam o rendimento da reação.
- B. alteram a velocidade de uma reação por reduzir sua variação de entalpia
 o que diminui a energia necessária para a obtenção dos produtos.
o que diminui a energia necessária para a obtenção dos produtos. - C.
alteram o equilíbrio de uma reação pois, ao acelerar a formação de produtos, deslocam este equilíbrio na direção da maior formação desses produtos, conforme predito pelo Princípio de Le Chatelier.
- D.

- E.
fornecem uma área maior onde os reagentes se aderem para que a reação possa ocorrer em sua superfície.
A oxidação de materiais ferrosos pelo oxigênio atmosférico é um processo de corrosão muito comum em indústrias e residências. As semirreações envolvidas neste processo são:

- A.
reação não será espontânea, necessitando de um catalisador para ocorrer, uma vez que o valor de
 dessa reação é próximo a zero.
dessa reação é próximo a zero. - B.
reação será espontânea, pois existe uma grande diferença de potencial entre as espécies químicas envolvidas, uma vez que o valor de
 é igual a −0,810 V.
é igual a −0,810 V. - C.

- D.

- E.
valor de
 é negativo e, assim, este processo de corrosão não será espontâneo, necessitando de um catalisador para ocorrer.
é negativo e, assim, este processo de corrosão não será espontâneo, necessitando de um catalisador para ocorrer.
Os trabalhos pioneiros de químicos e físicos dos séculos XVII, XVIII e XIX permitiram a elaboração de diversas equações relacionadas às propriedades dos gases, que mais tarde foram combinadas, formando a lei geral dos gases ideais, que explica diferentes fenômenos envolvendo gases. Com base nesta lei, analise as afirmativas a seguir.

É(São) correta(s) APENAS a(s) afirmativa(s)
- A.
I
- B.
II.
- C.
III.
- D.
I e II.
- E.
II e III.


