Questões sobre Reações, Soluções e Transformações Químicas
Lista completa de Questões sobre Reações, Soluções e Transformações Químicas para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Fundação Sousândrade de Apoio ao Desenvolvimento da UFMA (FSADU) - 2010

- A. Síntese.
- B. Oxi redução.
- C. Análise.
- D. Deslocamento.
- E. Ônica.
Química - Reações, Soluções e Transformações Químicas - Fundação Sousândrade de Apoio ao Desenvolvimento da UFMA (FSADU) - 2010
Um laboratorista químico preparou uma solução a 30% de um determinado sal. Abaixo, uma das opções contém a massa exata de água destilada que devemos acrescentar a esta solução para que a mesma seja diluída a 10%. Qual é esta opção?
- A. 100 gramas.
- B. 50 gramas.
- C. 150 gramas.
- D. 1000 gramas.
- E. 200 gramas.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2010
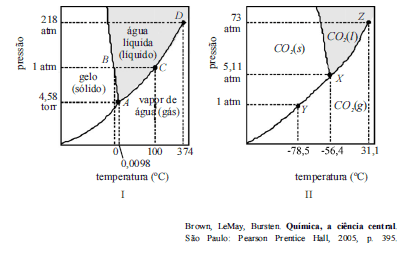
A partir das informações contidas nos diagramas I e II mostrados acima, cujas escalas não foram observadas, é correto afirmar que
- A.
se tornam idealmente distintas as fases da água e do dióxido de carbono somente após pressões superiores às dos pontos D e Z, respectivamente.
- B.
os diagramas da água e do dióxido de carbono demonstram comportamento típico apresentado pela maioria das substâncias.
- C.
colocar alimento congelado em câmara frigorífica sob temperatura em torno de 0,01 oC e sob pressão inferior a 4,58 torr implica a sublimação do gelo nele contido.
- D.
o dióxido de carbono sólido funde-se quando aquecido sob pressão de 4,58 atm.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2010
Texto para as questões de 41 a 44

Ainda em relação às informações contidas no texto, assinale a opção correta.
- A.
A purificação da bauxita é um processo hidrometalúrgico.
- B.
O alumínio é encontrado nas jazidas em forma de substância elementar em ligas com pelo menos três outros metais.
- C.
A bauxita é fonte industrial de ferro e de silício, além de ser utilizada para a obtenção de titânio.
- D.
A produção anual de alumina, no Brasil, é de 6,5 milhões de toneladas.
O gás natural é caracterizado por uma mistura de hidrocarbonetos que, na condição de temperatura ambiente e pressão atmosférica, permanece no estado gasoso, o que facilita sua utilização em residências para cocção de alimentos e aquecimento de água. Dentre suas características, destaca-se o fato de o gás natural
- A.
ser mais pesado do que o ar, acumulando-se nas proximidades de um eventual vazamento.
- B.
ser economicamente atrativo, desde que distribuído na forma de gás natural comprimido.
- C.
apresentar um forte odor quando não queimado.
- D.
assemelhar-se ao GLP no que diz respeito à rápida dissipação para a atmosfera em caso de vazamento.
- E.
liberar dióxido de carbono e vapor dágua (ambos não tóxicos) durante sua combustão completa.
Com relação à tabela periódica e às reações de oxidorredução, assinale a alternativa correta.
- A.
A energia de ionização (EI) cresce da esquerda para a direita; no entanto, a EI do alumínio é menor que a do magnésio.
- B.
Todos os halogênios formam hidrácidos fortes.
- C.
Os óxidos metálicos têm caráter ácido.
- D.
Os elementos metálicos não formam compostos hidrogenados.
- E.
O raio do íon Mg+2 é maior do que o raio do Mg metálico.
Os ácidos e as bases são substâncias muito encontradas na natureza. Os ácidos apresentam sabor azedo, e as bases são adstringentes. Essas substâncias são largamente estudadas e bem definidas. Assinale a alternativa correta acerca desse tema.
- A.
De acordo com as definições de ácido e base, o ácido fluorídrico é um ácido de Lewis.
- B.
Quanto maior o pKa de um ácido, mais forte será o ácido.
- C.
Em uma reação em equilíbrio, a constante de equilíbrio é a relação entre a concentração molar dos reagentes e a concentração molar dos produtos.
- D.
Um sal derivado de uma base fraca tem caráter básico.
- E.
Uma solução tampão é formada pela mistura de um ácido fraco e o seu sal derivado ou de uma base fraca e o seu sal derivado.
Na natureza, as substâncias e os elementos não são encontrados em estado puro. Para a obtenção das substâncias puras, é necessário fazer a extração e a purificação delas. Para isso, são usados processos físicos e químicos. Com relação a esse assunto, assinale a alternativa correta.
- A.
A obtenção dos metais puros é feita pela fusão do minério.
- B.
B) A obtenção do sódio metálico é realizada por meio da eletrólise da água do mar.
- C.
É possível transformar a água poluída em água potável por meio de uma reação química.
- D.
Na preparação do biocombustível, ocorre a formação de glicerina, a qual pode ser extraída com água.
- E.
O limoneno é muito usado na preparação de balas e doces e pode ser extraído do limão pela prensagem da polpa.
Considere um experimento em que se estude o índice de octanagem da gasolina em função da adição de dois aditivos, I e II, em %. Os resultados dos ensaios realizados e o coeficiente de correlação referente à experiência I estão apresentados nas tabelas a seguir.

Considerando-se que, com o aditivo II, o índice de octanagem cresceu sistematicamente 10% em relação ao índice obtido com o aditivo I, para os mesmos % de aditivo, o valor de X é
- A.
0,82
- B.
0,89
- C.
0,90
- D.
0,90
- E. 1,00
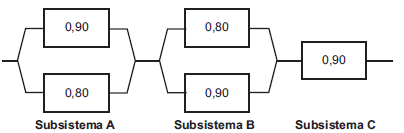
Considere o diagrama acima, formado por três subsistemas, representando a estrutura operacional de um sistema eletrônico. A probabilidade de cada componente operar adequadamente está explicitada no diagrama. Para que o sistema funcione, é necessário que o subsistema C e pelo menos um dos componentes de cada um dos subsistemas A e B funcionem. Supondo-se que os componentes operem de forma independente, a probabilidade de que o sistema funcione é
- A.
(0,9) (0,98)2
- B.
(0,9) (0,98) (0,97)
- C.
1 − (0,9) (0,97)2
- D.
(0,85)2 (0,9)
- E.
1 − (0,9) (0,98)2


