Questões de Química da Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ)
Lista completa de Questões de Química da Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Química Cinética - Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) - 2014
Um sal hidratado é analisado por gravimetria para determinação de sua composição. Inicialmente é aquecido até perder a água de cristalização, tornado-se um sal anidro. Em seguida, a temperatura é aumentada até ocorrer a decomposição térmica do sal. Analisando grafi camente o processo, medindo-se a variação de massa (m) em função da temperatura (θ), o gráfi co que melhor representa os resultados obtidos é:
- A.

- B.

- C.

- D.

- E.

Química - Reações, Soluções e Transformações Químicas - Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) - 2014
Existe grande interesse nas estruturas, propriedades e usos dos compostos de coordenação formados pelos íons metálicos, que agem como ácidos de Lewis, e seus ligantes, que são bases de Lewis, em parte devido à importância biológica dessas espécies químicas. Suas propriedades são fortemente infl uenciadas pelo tipo de ligante e pela geometria. A isomeria também é um fenômeno muito comum entre os compostos de coordenação. Dentre os pares de complexos:
[Cu(NH3)4][PtCl4] e [Pt(NH3)4][CuCl4] [Cr(NH3)6][Fe(CN)6] e [Fe(NH3)6][Cr(CN)6] O tipo de isomeria que ocorre é de:- A. ionização
- B. coordenação
- C. ligação
- D. hidratação
- E. estereoisomeria

- A. 47,4 e 0,92
- B. 9,2 e 47,4
- C. 4,74 e 0,92
- D. 63,5 e 22,4
- E. 6,35 e 2,24
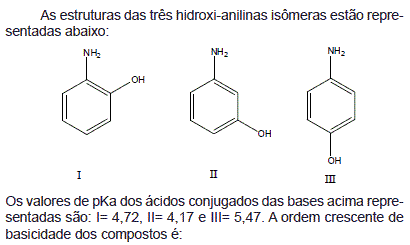
- A. III < II < I
- B. II < III < I
- C. I < III < II
- D. II < I < III
- E. I < II < III
Química - Reações, Soluções e Transformações Químicas - Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) - 2014
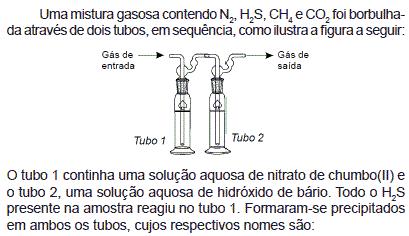
- A. sulfato de chumbo II e carbonato de bário
- B. sulfeto de chumbo II e carbeto de bário
- C. sulfi to de chumbo II e carbonato de bário
- D. sulfeto de chumbo II e carbonato de bário
- E. sulfato de chumbo II e carbeto de bário
Química - Química Inorgânica - Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) - 2014
Um álcool de fórmula molecular C5H12O, que possui um carbono assimétrico, sofre oxidação com clorocromato de piridínio (PCC formado pela dissolução do óxido de cromo VI em ácido clorídrico e posterior tratamento com piridina), um agente oxidante mais seletivo que o permanganato de potássio (KMnO4) ou o ácido crômico (H2CrO4 - formado pela dissolução do óxido de cromo VI em ácido sulfúrico). O nome ofi cial do produto formado nessa reação é:
- A. ácido 2-metil-butanoico
- B. ácido 3-metil-butanoico
- C. pentan-2-ona
- D. 3-metil-butanal
- E. 2-metil-butanal
Química - Reações, Soluções e Transformações Químicas - Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) - 2014

- A. aumentar a pressão
- B. aumentar a temperatura
- C. diminuir a pressão
- D. diminuir a temperatura
- E. adicionar catalisador

- A. 17160
- B. 15840
- C. 13220
- D. 16350
- E. 14550
Química - Reações, Soluções e Transformações Químicas - Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) - 2014
A entalpia padrão de combustão (ΔHC °) de uma substância pode ser determinada experimentalmente em um calorímetro de bomba. Um aparelho desses foi calibrado e sua capacidade calorífi ca determinada foi de 641J.K-1. Ao se promover a queima de 0,64g de glicose (C6H12O6) no calorímetro, nas condições-padrão, a temperatura aumentou de 15,6K. Então, pode-se afi rmar que ΔHC ° da glicose, em kJ.mol-1, é aproximadamente igual a:
- A. +2800
- B. -2800
- C. +1000
- D. -1000
- E. - 3600
Química - Reações, Soluções e Transformações Químicas - Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) - 2014
O arsênio é um elemento químico muito tóxico que, no estado de oxidação +3, é letal para os humanos em doses de 140mg ou mais. É encontrado principalmente nos minerais arsenopirita, realgar e orpimento, que são sulfetos desse elemento. A reação entre sulfeto de arsênio III, ácido nítrico e água produz ácido sulfúrico, ácido arsênico e óxido nítrico gasoso. Após escrever a equação química completa e balanceada, a soma de todos os menores coefi cientes estequiométricos inteiros é igual a:
- A. 60
- B. 78
- C. 58
- D. 80
- E. 70


