Questões de Química da Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ)
Lista completa de Questões de Química da Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) - 2014
A variação de energia livre de Gibbs (ΔG) é uma medida da variação total de entropia de um sistema e suas vizinhanças, à pressão e temperatura constantes e prevê a espontaneidade da ocorrência de um processo, de acordo com a segunda Lei da Termodinâmica. Cinco reações químicas, numeradas por I, II, III, IV e V, cujas variações de entalpia (ΔH) e entropia (ΔS) são conhecidas, devem ser escolhidas para sua realização à mesma temperatura. São mostrados a seguir os dados relativos a cada uma das reações: Reação I - ΔH positivo e ΔS negativo, sendo que o ΔS multiplicado pela temperatura gera um valor numérico menor que o do ΔH. Reação II - ΔH positivo e ΔS positivo, sendo que o ΔS multiplicado pela temperatura gera um valor numérico menor que o de ΔH. Reação III - ΔH positivo e ΔS negativo, sendo que o ΔS multiplicado pela temperatura gera um valor numérico maior que o de ΔH. Reação IV - ΔH negativo e ΔS negativo, sendo que o ΔS multiplicado pela temperatura gera um valor numérico maior que o de ΔH. Reação V - ΔH positivo e ΔS positivo, sendo que o ΔS multiplicado pela temperatura gera um valor numérico maior que o de ΔH. Segundo dados exclusivamente termodinâmicos, a reação a ser escolhida é a de número:
- A. I
- B. II
- C. III
- D. IV
- E. V
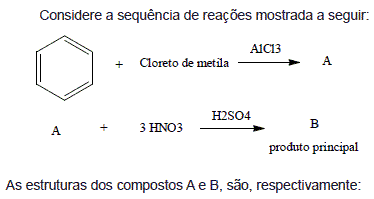
- A.

- B.

- C.

- D.

- E.

Um químico titula 50,00 mL de uma solução de ácido sulfúrico com uma solução 0,2500 mol.L-1 de hidróxido de sódio. Entretanto, ele se distrai e ultrapassa o ponto de equivalência e tem que fazer uma titulação de retorno com uma solução 0,2000 mol.L-1 de ácido clorídrico para obter um ponto final apropriado. Se ele adicionou 65,00 mL de hidróxido e gastou 5,000 mL de ácido clorídrico, o valor encontrado para a concentração do ácido sulfúrico foi, em mol.L-1, aproximadamente igual a:
- A. 0,1525
- B. 0,0125
- C. 0,0152
- D. 0,1250
- E. 0,0250

- A. 9,72% e 15,28%
- B. 15,28% e 9,72%
- C. 5,4% e 19,6%
- D. 8,1% e 16,9%
- E. 16,9% e 8,1%

- A. álcool, amida, éter, éster e cetona
- B. ácido carboxílico, amina, éter, éster e cetona
- C. álcool, amina, éster, éter e cetona
- D. álcool, fenol, amina, éter, éster e aldeído
- E. ácido carboxílico, amina, éter, éster e aldeído
Química - Reações, Soluções e Transformações Químicas - Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) - 2014

- A. 611
- B. 6,11
- C. 6110
- D. 1222
- E. 12,22
Química - Química Inorgânica - Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) - 2014
A geometria molecular envolve o estudo da organização espacial dos átomos em uma molécula e permite a compreensão de muitas propriedades de uma substância. A Teoria da Repulsão dos Pares Eletrônicos da Camada de Valência (RPECV ou VSEPR em inglês) é uma ferramenta útil na sua determinação. De acordo com esta teoria, as formas moleculares corretas das espécies químicas XeF4, ICl3, TeO3 e POCl3 são,respectivamente:
- A. tetraédrica, pirâmide trigonal, trigonal planar e bipirâmide trigonal
- B. quadrado planar, pirâmide trigonal, pirâmide trigonal e tetraédrica
- C. tetraédrica, forma T, trigonal planar e bipirâmide trigonal
- D. tetraédrica, forma T, pirâmide trigonal e tetraédrica
- E. quadrado planar, forma T, trigonal planar e tetraédrica
Considere quatro elementos químicos representados genericamente por A, B, M e R, de números atômicos consecutivos e crescentes. Sabe-se que B é o halogênio que demanda mais energia para formar um cátion. Então, a soma dos números de elétrons dos íons A2- e R+ é igual a:
- A. 19
- B. 20
- C. 26
- D. 30
- E. 39


