Questões de Química da Fundação CESGRANRIO (CESGRANRIO)
Lista completa de Questões de Química da Fundação CESGRANRIO (CESGRANRIO) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação CESGRANRIO (CESGRANRIO) - 2011
A acetona é um líquido cuja diferença de temperatura entre os pontos de ebulição e de fusão é de 150 ºC, a uma determinada pressão. Considere constante o coeficiente de dilatação volumétrica da acetona: 1,5 x 103 ºC1. A razão entre a densidade da acetona líquida à temperatura de ebulição e a densidade da acetona líquida à temperatura de solidificação, nesse caso, é
- A. 1,0
- B. 0,8
- C. 0,6
- D. 0,4
- E. 0,2
A cromatografia é amplamente utilizada em análises de gases e líquidos para a determinação dos componentes químicos contidos em uma amostra. A esse respeito, afirma-se que
- A.
a cromatografia gasosa é constituída pelas fases móvel e estacionária.
- B.
os componentes de uma mistura que possuem o mesmo ponto de ebulição são separados na cromatografia gasosa.
- C.
um gás de arraste, para transportar a amostra através da coluna de separação até o detector, é utilizado na fase estacionária.
- D.
os gases de arraste para coluna de líquido devem ser quimicamente miscíveis e possuir baixa pureza.
- E.
os detectores são dispositivos que transformam as variações na composição do gás de arraste em sinais pneumáticos.
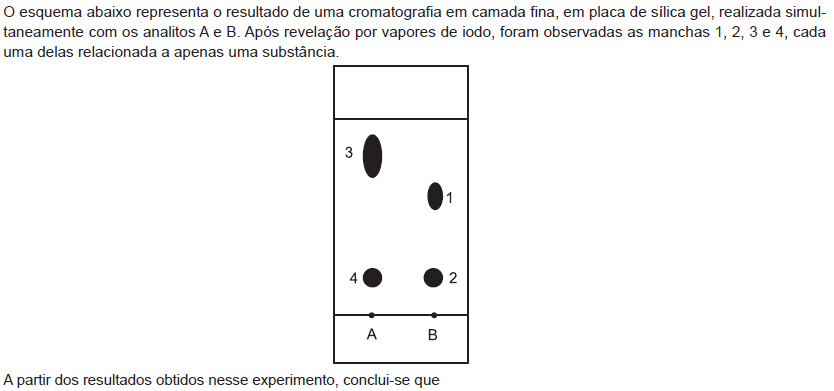
- A.
a substância 3 é a menos polar dentre as substâncias 1, 2, 3 e 4.
- B.
a substância 3 possui o menor Rf dos quatro componentes separados.
- C.
as substâncias 1 e 3 possuem a mesma polaridade.
- D.
as substâncias 2 e 4 são idênticas.
- E.
o eluente escolhido é inadequado para separar as substâncias 1 e 2, presentes no analito B.

- A. I e II, apenas.
- B. II e III, apenas.
- C. II e IV, apenas.
- D. I, III e IV, apenas.
- E. I, II, III e IV.
O fogo surgiu junto à tomada elétrica de piso da sala, próximo à lixeira de papel. Havia vários computadores funcionando, ligados àquela tomada através de um dispositivo improvisado. Naquela sala, a ventilação natural era propiciada por amplas janelas, por onde entrava o vento em corrente. Dois equipamentos estavam disponíveis para o combate àquele princípio de incêndio: ambos eram aparelhos portáteis, sendo, o primeiro, de dióxido de carbono, e o outro, de pó químico. Da equipe de trabalho naquele local, no momento, fazia parte um Técnico em Logística de Transporte que pertencia à Brigada de Incêndio da unidade de negócios. Imediatamente ele definiu, com êxito, o segundo dos aparelhos disponíveis, como o mais eficaz para a extinção daquele pequeno foco de fogo porque apresentava as vantagens de
- A.
manter a temperatura do local, sem interferir no processo de resfriamento do ponto de origem do fogo que, assim, extingue-se de forma gradual por abafamento.
- B.
sofrer menos influência da corrente de ar existente em seu agente extintor, e apagar o fogo com maior velocidade por interferir diretamente na reação em cadeia do fogo.
- C.
umedecer o local e deixar pouco resíduo prejudicial na posterior operação de rescaldo ou na recuperação dos equipamentos expostos à sua ação durante o combate ao fogo.
- D.
ser mais suscetível à aerodispersão do pó químico, o que gera resfriamento numa área mais extensa, além de o fato do extintor de pó químico ser mais pesado que o dióxido de carbono.
- E.
ser volátil, misturando-se com o ar atmosférico e, assim, ser mais facilmente transportado na corrente de ar, até o ponto onde estão surgindo as chamas, que logo se retraem.
A utlização do eletrodo de Ag/AgCl pode ser tanto como eletrodo de referência quanto como eletrodo indicador.
PORQUE
O eletrodo Ag/AgCl tem um potencial conhecido, que é essencialmente constante e insensível à composição das soluções de estudo, sendo, ainda, construído com base em uma reação reversível; obedece à Equação de Nerst, pode retornar ao seu potencial original após ser submetido a pequenas correntes e exibe baixa histerese sob ciclos de temperatura. A esse respeito, conclui-se que
- A.
as duas afirmações são verdadeiras, e a segunda justifica a primeira.
- B.
as duas afirmações são verdadeiras, e a segunda não justifica a primeira.
- C.
a primeira afirmação é verdadeira, e a segunda é falsa.
- D.
a primeira afirmação é falsa, e a segunda é verdadeira.
- E.
as duas afirmações são falsas.
A caracterização dos elétrons como parte da matéria se deu através dos tubos de raios catódicos, que consistiam em um tubo selado com um gás e eletrodos metálicos conectados aos polos de uma fonte.
Thomson é o mais famoso cientista dentre os que trabalharam com os tubos de raios catódicos. Sua experiência baseou-se na interação dos raios catódicos com campos magnético e elétrico conhecidos para determinar a razão carga/massa dessas partículas. Além dos raios catódicos, também foram observados os chamados raios canais, de carga positiva, que eram os íons dos gases presentes nas ampolas. Analise as afirmações a seguir sobre as experiências com tubos de raios catódicos e raios canais. I Os raios catódicos são atraídos por uma chapa metálica ligada ao polo positivo de uma bateria. II A mudança dos gases no interior dos tubos não afeta a razão carga/massa dos raios catódicos. III A razão carga/massa dos raios canais é dependente do gás presente no interior das ampolas. IV Ao inverter a ligação dos polos da fonte com os eletrodos das ampolas, os raios catódicos se transformam em prótons. Estão corretas APENAS as afirmativas- A. I e IV.
- B. II e IV.
- C. II e III.
- D. I, II e III.
- E. I, III e IV.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação CESGRANRIO (CESGRANRIO) - 2011
Em função de suas características físico-químicas, a água utilizada
- A.
em combate a princípio de incêndio, tem dificuldade de escorrer da superfície do líquido inflamável, facilitando sua penetração na massa líquida.
- B.
em jato compacto, é inadequada para combater o fogo em líquidos inflamáveis de baixo ponto de fulgor, derivados do petróleo.
- C.
com a velocidade de seu jato reduzida através da adição de componentes químicos, elimina o risco do fenômeno água rápida.
- D.
na forma de neblina, serve para combater incêndios de grandes proporções, em líquidos inflamáveis.
- E.
no combate a início de incêndio num motor elétrico de bomba de combustível, em funcionamento, deve estar em jato compacto.
Uma solução de uma dada amostra apresenta absortividade de 200 Lmol1cm1. Foi analisada por espectroscopia na região do UV/Vis em um comprimento de onda na qual se obedece à lei Lambert Beer na concentração empregada nesse experimento. Considere que o caminho óptico é de 1 mm, e a absorbância observada é 0,4. Empregando esse resultado na equação de Lambert-Beer, conclui-se que a concentração da amostra é, aproximadamente,
- A.
0,01 molL1
- B.
0,02 molL1
- C.
0,002 molL1
- D.
8,0 molL1
- E.
80 molL1

- A. 25 e 30
- B. 30 e 35
- C. 35 e 40
- D. 40 e 45
- E. 45 e 50


