Questões de Química da Fundação CESGRANRIO (CESGRANRIO)
Lista completa de Questões de Química da Fundação CESGRANRIO (CESGRANRIO) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Ao se eliminar a presença do oxigênio num ambiente onde está ocorrendo um princípio de incêndio, proporciona-se a descontinuidade da existência do Triângulo do Fogo no local. A consequência desse fato é a(o)
- A.
extinção do fogo por abafamento.
- B.
queima somente do material orgânico no ambiente.
- C.
transformação do fogo em incêndio.
- D.
alastramento do fogo para onde haja mais combustível.
- E.
risco de explosão por insuficiência de comburente.
Para se determinar o teor de cloreto em 1 litro de uma solução salina pelo método de Volhard, retirou-se uma alíquota de 25 mL da mesma, que foi tratada com 40 mL de uma solução padrão de nitrato de prata com concentração 0,150 M. Após a precipitação quantitativa do cloreto na forma de AgCl, titulou-se o excesso de prata remanescente com uma solução padrão de KSCN 0,200 M, contendo íons Fe3+ como indicador. O volume de titulante gasto para se atingir o ponto de equivalência foi de 5 mL. Com base nesses dados, conclui-se que a massa de cloro presente na forma de cloreto na solução inicial é, aproximadamente, de
- A.
0,2 g
- B.
1,0 g
- C.
5,0 g
- D.
6,0 g
- E.
7,0 g
O seguinte procedimento foi realizado para se preparar uma solução de cloreto de cálcio:
I foram pesados 2,22 g de cloreto de cálcio; II a massa do sal foi dissolvida em 200 ml de água em um béquer; III transferiu-se o conteúdo do béquer para um cilindro graduado, onde se adicionou água até que o volume de solução fosse de 500 ml. Se 100 ml da solução de cloreto de cálcio foi misturada a 100 ml de uma solução aquosa de cloreto de sódio 5,85 g/L, a concentração de íons cloreto, em mol/L, na mistura, é de- A. 7,00 x 102
- B. 9,00 x 102
- C. 1,20 x 101
- D. 1,40 x 101
- E. 1,80 x 101
Os elementos constituintes do esquema didático conhecido como Triângulo do Fogo são
- A.
comburente, combustível e fonte de ignição.
- B.
combustível, fonte de ignição e energia de ativação.
- C.
energia de ativação, gases quentes e acetileno.
- D.
hidrogênio, fonte de ignição e combustível.
- E.
oxigênio, álcool e fonte de ignição.
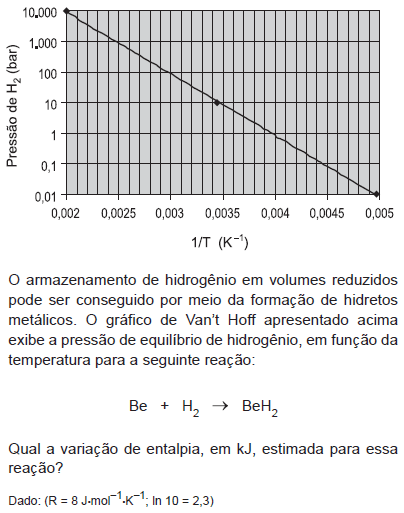
- A.
37
- B.
20
- C.
0
- D.
35
- E.
47
A síntese da amônia a partir dos gases hidrogênio e nitrogênio era um dos grandes desafios da humanidade entre o final do século XIX e o início do século XX. O maior problema envolvido nessa reação era a baixa conversão em amônia, que inviabilizava a produção em escala industrial. O estudo do equilíbrio químico dessa reação envolveu diversos cientistas, sendo Fritz Haber o nome mais celebrado, por obter as condições reacionais como temperatura, pressão e catalisadores, que permitiram a produção de amônia em grande escala. Considere que, em um sistema fechado, tal processo atingiu o equilíbrio com pressão de 1,0 atm e temperatura de 450 K. Sabendo-se que essa é uma reação exotérmica, analise as afirmativas a seguir.
I É possível formar mais amônia com a pressão de 1,0 atm se a temperatura for menor que 450 K. II Na temperatura de 450 K e pressão de 1,0 atm, não há formação de amônia, porque o processo está em equilíbrio. III Com a pressão em 1,0 atm e a temperatura de 450 K, é possível formar mais amônia, utilizando um catalisador. IV Para formar mais amônia na temperatura de 450 K, é preciso que a pressão seja maior que 1,0 atm. São corretas APENAS as afirmativas- A. I e IV.
- B. II e III.
- C. III e IV.
- D. I, II e III.
- E. I, II e IV.
Com relação a incêndios, é correto afirmar-se que fogo é um(a)
- A.
resultado palpável de reação de oxidação que envolve contato físico entre combustível, fonte de ignição e gases devidamente aquecidos.
- B.
resultado visível de uma reação de combustão, na qual o comburente produz gases que se queimam, produzindo luz e calor.
- C.
aparência dos gases queimados numa reação entre o oxigênio e o comburente na presença de um combustível.
- D.
consequência da reação química de oxidação, conhecida como combustão, favorecida por uma energia de iniciação.
- E.
forma em que se apresenta o conteúdo energético de uma reação química entre o ar atmosférico e um combustível em qualquer de seus estados físicos.
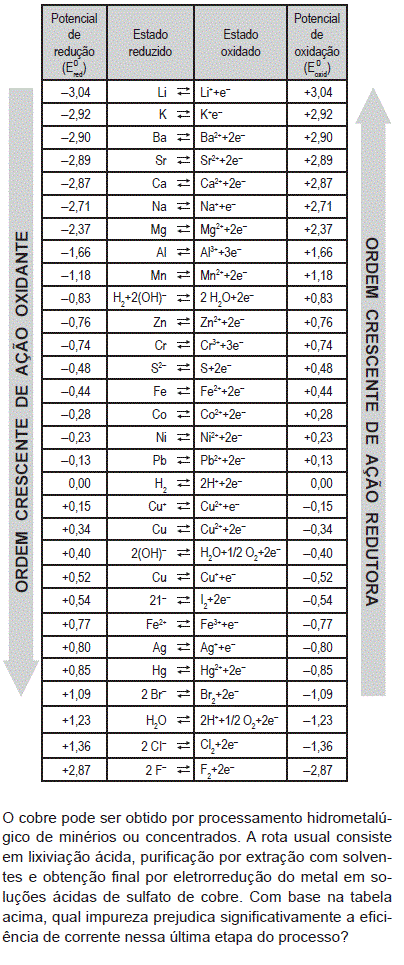
- A.
Mn
- B.
Cr
- C.
Co
- D.
Fe
- E.
F
As fórmulas químicas corretas do metasilicato de sódio, cromato de potássio, tiossulfato de sódio e tiocianato de sódio são, respectivamente,
- A. Na2SiO3 , K2CrO4 , Na2S2O3 e NaSCN
- B. Na2SiO4 , K2CrO4 , Na2S2O3 e NaNCS
- C. Na2SiO4 , K2Cr2O7 , Na2S2O7 e NaSCN
- D. Na2SiO3 , K2Cr2O7 , Na2S2O7 e NaNCS
- E. Na2Si2O3 , K2Cr2O7 , Na2S2O7 e NaSCN
Misturas de líquidos ou líquidos que contenham sólidos em solução ou suspensão, constituem os líquidos inflamáveis, substâncias que
- A.
produzem vapor inflamável até 65,0 ºC em ensaio de vaso fechado.
- B.
produzem vapor inflamável até 60,5 ºC em ensaio de vaso fechado.
- C.
apresentam ponto de fulgor até 67,6 ºC em ensaio de vaso aberto.
- D.
apresentam ponto de fulgor até 66,7 ºC em ensaio de vaso aberto.
- E.
apresentam ponto de ignição a 66,7 ºC em ensaio de vaso fechado.


