Questões de Química da Fundação CESGRANRIO (CESGRANRIO)
Lista completa de Questões de Química da Fundação CESGRANRIO (CESGRANRIO) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Considere as espécies abaixo. 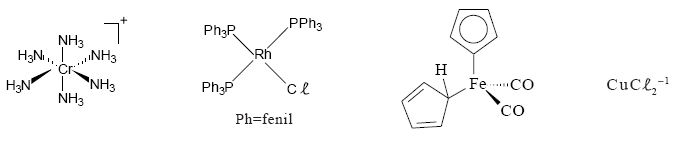 A geometria do composto organometálico é:
A geometria do composto organometálico é:
- A.
tetraédrica.
- B.
octaédrica.
- C.
linear.
- D.
tetragonal planar.
- E.
pirâmide de base quadrada.
Para avaliar o nível de poluição de um curso d'água, foram analisadas amostras coletadas em seis pontos distintos desse rio. Os resultados obtidos para oxigênio dissolvido (OD), demanda bioquímica de oxigênio (DBO) e demanda química de oxigênio (DQO) estão apresentados nos gráficos abaixo. 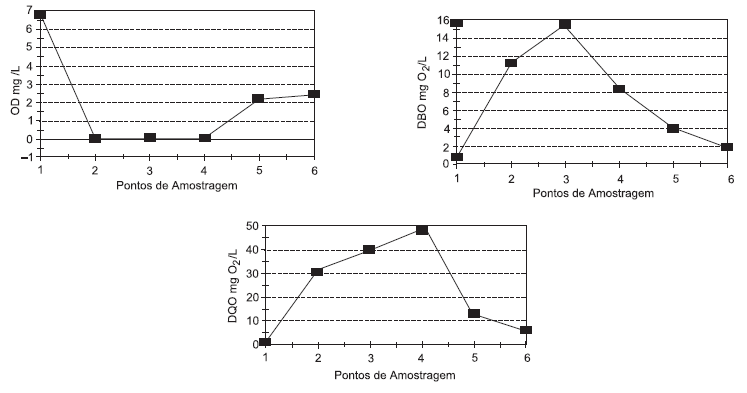 Os resultados dessas análises indicam que:
Os resultados dessas análises indicam que:
- A.
a amostra coletada no ponto 4 apresentou maior contribuição de poluição biodegradável e não biodegradável.
- B.
a contaminação sofrida pelo rio é causada apenas por material não biodegradável.
- C. a soma DBO + DQO expressa a demanda de O2 necessária para eliminar todo o material oxidável presente na água.
- D.
o ponto de amostragem correspondente à maior poluição biodegradável é o de número 3.
- E.
os pontos de amostragem de números 2, 3 e 4 são igualmente poluídos.
Considere os seguintes equilíbrios químicos e suas constantes KI, KII e KIII: 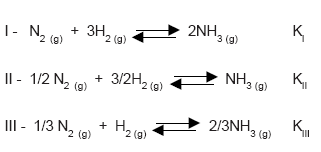 A alternativa que relaciona corretamente as constantes de equilíbrio, a uma mesma temperatura, é:
A alternativa que relaciona corretamente as constantes de equilíbrio, a uma mesma temperatura, é:
- A.
KI = KII = KIII
- B.
KI = 2KII = 3KIII
- C.
KI = KII/2 = KIII/3
- D.
KI = (KII)2 = (KIII)3
- E.
KI = (KII)1/2 = (KIII)1/3
Nos garimpos da Amazônia, o mercúrio metálico é empregado na extração de ouro e, por ser um metal de alta toxicidade com propriedades bioacumulativas, acarreta sérios danos ao meio ambiente e à saúde humana. Vários estudos têm sido realizados visando ao controle dos teores de mercúrio em águas, solos e alimentos. Em geral, a metodologia envolve um pré-tratamento da amostra, através da redução química do mercúrio para liberá-lo em sua forma metálica, de modo a proceder à determinação quantitativa do metal na matriz estudada. Dentre as técnicas analíticas abaixo, aquela adequada a determinações quantitativas de mercúrio é a:
- A.
cromatografia em coluna.
- B.
espectrofotometria de absorção atômica.
- C.
espectroscopia de absorção molecular no infravermelho.
- D.
cromatografia gasosa com detector de ionização por chama.
- E.
cromatografia gasosa acoplada à espectrometria de massas.
Considere o diagrama de equilíbrio das fases sólida, líquida e vapor da água ilustrado esquematicamente abaixo e as afirmativas que se seguem.
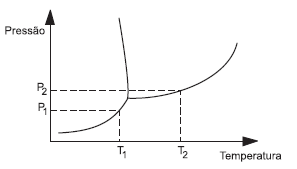
I - Um aumento da pressão externa provoca um abaixamento do ponto de fusão do sólido.
II - Uma diminuição de pressão externa provoca uma elevação no ponto de ebulição do líquido.
III - A pressão P1 corresponde à pressão de vapor do líquido na temperatura T1.
IV - A pressão P2 corresponde à pressão de vapor do líquido a temperatura T2.
Estão corretas apenas as afirmações
- A.
I e II.
- B.
I e III.
- C.
I e IV.
- D.
II e III.
- E.
II e IV.
O teor de cobre em uma amostra de sal de cobre II foi determinado por titulação de oxirredução indireta utilizando-se o seguinte procedimento: uma amostra com 3,0 g do sal foi dissolvida em água deionizada e avolumada em balão volumétrico de 250 mL. Uma alíquota de 50,00 mL foi, então, tratada com 1g de KI, conforme a reação abaixo.
Cu+2 + 2I− → Cu+1 + I2
Em seguida, o iodo liberado foi convertido a I− através de titulação. O titulante adequado a esta análise é o:
- A.
K2Cr2O7.
- B. KMnO4.
- C. Ce(SO4)2.
- D. Na2S2O3.
- E.
KIO3.
Considere os mais simples orbitais atômicos s, p, d e f (1s, 2p, 3d e 4f). A soma total do número de planos nodais existentes nesses quatro orbitais é:
- A.
1
- B.
3
- C.
5
- D.
6
- E.
7
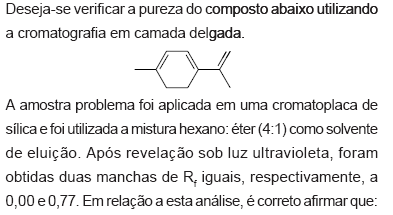
- A.
a amostra apresentou apenas um contaminante.
- B.
a amostra apresentou dois contaminantes.
- C.
o valor de Rf igual a 0,77 será diminuído se a proporção de hexano for aumentada.
- D.
para deslocar a mancha de Rf igual a zero, deve-se aumentar a polaridade do solvente de eluição.
- E.
nas condições experimentais, não é possível determinar se a amostra contém impureza.
Um mol do hidrocarboneto A reage com um mol de H2 em presença de platina, formando o 3-metilpentano. A reação de A com KMnO4 a quente produz um ácido carboxílico e uma cetona. A cetona produzida nesta reação e o principal produto obtido quando A reage com HCl, respectivamente, são:
- A.
butanona; 3-cloro-3-metilpentano.
- B.
butanona; 2-cloro-3-metilpentano.
- C.
3-pentanona; 3-cloro-3-metilpentano.
- D.
3-metil-2-pentanona; 1-cloro-3-metilpentano.
- E.
3-metil-2-pentanona; 2-cloro-3-metilpentano.
A extração líquido-líquido é um dos possíveis procedimentos analíticos utilizados na extração de pesticidas organoclorados a serem dosados em amostras de águas superficiais e subterrâneas. Dentre os solventes abaixo, aquele adequado a este tipo de extração é a(o):
- A.
acetona.
- B.
acetonitrila.
- C.
1-propanol.
- D.
acetato de etila.
- E.
dimetil-sulfóxido.


