Questões de Química da Centro de Seleção e de Promoção de Eventos UnB (CESPE)
Lista completa de Questões de Química da Centro de Seleção e de Promoção de Eventos UnB (CESPE) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008

- A.
Quando a chama se extingue, ocorre um abaixamento da temperatura e o ar no interior do copo se contrai fortemente, o que provoca a entrada de água no copo.
- B.
O oxigênio do ar é consumido, aumentando a pressão dentro do copo e, conseqüentemente, forçando a entrada de água para o interior do mesmo.
- C.
O produto da combustão, por ser gasoso, ocupa menor espaço que a vela sólida e a água substitui o espaço liberado pela vela consumida.
- D.
A experiência contraria a Lei de Lavoisier, pois nas reações de combustão não há conservação de massa.
Julgue os itens a seguir, acerca de conceitos de calor e temperatura.
O calor sempre flui de um meio de maior temperatura para o meio de menor temperatura.- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Aproximadamente 140 milhões de toneladas de gás amoníaco são produzidos anualmente pelo processo de Haber, que combina nitrogênio retirado do ar com gás hidrogênio, conforme representa a equação não-balanceada a seguir. O gás amoníaco é matéria-prima para a produção de ácido nítrico e NH4NO3, este último empregado como fertilizante e explosivo.
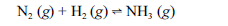
Considerando as informações acima e sabendo que M(H) = 1 g/mol e M(N) = 14 g/mol, julgue os itens a seguir.
O composto iônico de amônio empregado como fertilizante pode ser obtido conforme a equação a seguir.
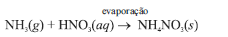
- C. Certo
- E. Errado
Assinale a opção que não contém um aspecto que deve ser enfatizado no ensino de ciências na abordagem CTS.
- A.
Ciência como um processo sócio-histórico em construção, que apresenta potencialidades e limitações.
- B.
Organização da matéria em temas tecnológicos e sociais.
- C.
Envolvimento com problemas verdadeiros no seu contexto real.
- D.
Investigação, observação, experimentação, coleta de dados e descoberta como método científico.
Julgue os itens a seguir, acerca de conceitos de calor e temperatura.
Existem dois tipos de calor: o quente e o frio.- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Aproximadamente 140 milhões de toneladas de gás amoníaco são produzidos anualmente pelo processo de Haber, que combina nitrogênio retirado do ar com gás hidrogênio, conforme representa a equação não-balanceada a seguir. O gás amoníaco é matéria-prima para a produção de ácido nítrico e NH4NO3, este último empregado como fertilizante e explosivo.
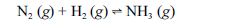
Considerando as informações acima e sabendo que M(H) = 1 g/mol e M(N) = 14 g/mol, julgue os itens a seguir.
Sabendo que a solubilidade do NH3 ,em 1 L de água, a 0 °C e 1 atm de pressão, é de 1.300 L, é correto concluir que as substâncias NH3 e H2O são fortemente polarizadas.- C. Certo
- E. Errado
Julgue os itens a seguir, relativos às habilidades que se pretende desenvolver nos alunos com uma proposta de ensino de ciências na abordagem CTS (ciência, tecnologia e sociedade).
I Entender a ciência como forma de conhecimento verdadeiro, que possibilita resolver os diferentes problemas da atualidade.
II Compreender de forma integrada o mundo natural, o mundo construído pelo homem e o mundo social do dia-a-dia.
III Participar democraticamente na sociedade por meio da expressão de suas opiniões.
IV Compreender a tecnologia como uma aplicação das diferentes formas de conhecimento para atender as necessidades atuais.
A quantidade de itens certos é igual a
- A.
1.
- B.
2.
- C.
3.
- D.
4.
Julgue os itens a seguir, acerca de conceitos de calor e temperatura.
Uma reação que apresenta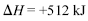 é endotérmica.
é endotérmica.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Aproximadamente 140 milhões de toneladas de gás amoníaco são produzidos anualmente pelo processo de Haber, que combina nitrogênio retirado do ar com gás hidrogênio, conforme representa a equação não-balanceada a seguir. O gás amoníaco é matéria-prima para a produção de ácido nítrico e NH4NO3, este último empregado como fertilizante e explosivo.
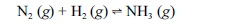
Considerando as informações acima e sabendo que M(H) = 1 g/mol e M(N) = 14 g/mol, julgue os itens a seguir.
Borbulhando-se NH3 em água, a solução resultante forma um ácido de Arrhenius.- C. Certo
- E. Errado
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Julgue os itens subseqüentes, relativos à alquimia e à química.
I Os alquimistas se empenharam na busca da cura de todos os males, procurando obter um elixir que proporcionasse um equilíbrio perfeito entre o ser humano e o universo.
II Para o pensamento alquímico, os minerais deixados em repouso, em suas matrizes tectônicas, na Mãe Terra, como embriões metálicos, acabariam tornando-se ouro após centenas de milhares de séculos. Caberia ao alquimista acelerar tal transformação.
III O pensamento alquímico dissipou-se com a ciência moderna, nada deixando à química de seu ideário.
IV Diversos processos e técnicas de manipulação da matéria, equipamentos e nomenclaturas foram herdados da alquimia pela ciência química.
A quantidade de itens certos é igual a
- A.
1.
- B.
2.
- C.
3.
- D.
4.


