Questões de Química da Centro de Seleção e de Promoção de Eventos UnB (CESPE)
Lista completa de Questões de Química da Centro de Seleção e de Promoção de Eventos UnB (CESPE) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
No que se refere aos métodos instrumentais de análise química, julgue os próximos itens.
Para uma determinação colorimétrica bem-sucedida, é essencial preparar uma série de soluções-padrão e construir uma curva de calibração.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007

A partir das informações acima, julgue os itens seguintes.

- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
Julgue os itens que se seguem.
Quando uma reação química atinge o equilíbrio, sua constante de equilíbrio é igual a zero
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
No que se refere aos métodos instrumentais de análise química, julgue os próximos itens.
Quando uma solução que contém íons de determinado metal é introduzida em uma chama, a evaporação do solvente deixa um resíduo sólido. A vaporização desse resíduo provoca a sua dissociação em átomos inicialmente no estado fundamental, capazes de absorver energia radiante em determinado comprimento de onda. A quantidade de luz absorvida é proporcional ao número de átomos que estão no estado fundamental presentes na chama e esse é o princípio básico da espectroscopia de absorção atômica (AAS).
- C. Certo
- E. Errado

Considerando essas informações, julgue os itens que se seguem.
O termo ouro branco, mencionado no texto, é uma metáfora, pois, do ponto de vista químico, o mineral ouro é formado por átomos ionizados de Au em ligação de natureza metálica.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
Julgue os itens que se seguem.
Considere que uma substância contamine a água de um lago formando uma solução aquosa de 25 mg/mL. Nesse caso, um processo que purifique a água em 90% com relação a esse contaminante irá liberar uma solução aquosa de concentração igual a 22,5 kg/m³ .
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
Uma das determinações clássicas da volumetria é a determinação da dureza da água. Esta é geralmente devida à presença de sais de cálcio e magnésio dissolvidos e pode ser determinada por titulação complexométrica com o ácido etilenodiaminotetracético (EDTA). Com relação a essa determinação, às titulações que utilizam EDTA e à volumetria de forma geral, considerando que a sigla EGTA refere-se ao ácido etilenoglicol-bis(2- aminoetiléter)-N,N,N',N'-tetracético, julgue os itens a seguir.
Como titulante, o EDTA apresenta as seguintes vantagens: possui uma ação complexante poderosa; é um ligante monodentado; forma anéis de seis membros, em que não há tensão por quelação; proporciona grande disponibilidade comercial a baixo preço.
- C. Certo
- E. Errado

Considerando essas informações, julgue os itens que se seguem.
A obtenção do sal de cozinha a partir da vaporização da água do mar por ebulição ocorre, a pressão de 1 atmosfera, em temperatura constante de 100 °C.
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2007
A crescente preocupação mundial com o esgotamento das reservas petrolíferas tem gerado um grande número de pesquisas para a obtenção de energia a partir de outras fontes. Uma dessas alternativas, que está em desenvolvimento, é a utilização de hidrogênio gerado a partir da oxidação do metano, segundo a equação química a seguir.
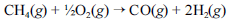
Na tabela a seguir, são fornecidas as entalpias de formação do metano e do monóxido de carbono.

A partir dessas informações, julgue os itens seguintes.
A dificuldade em confinar o gás hidrogênio em um recipiente está relacionada com a natureza corpuscular da matéria.
- C. Certo
- E. Errado
Acerca das propriedades, das técnicas de estudo e das leis que regem o comportamento físico de gases, líquidos e sólidos, julgue os itens a seguir.
Uma pressão constante aplicada a um líquido em equilíbrio se transmite integralmente a todos os pontos do líquido, mas não às paredes do recipiente que o contém.
- C. Certo
- E. Errado


