Questões de Química da Centro de Seleção e de Promoção de Eventos UnB (CESPE)
Lista completa de Questões de Química da Centro de Seleção e de Promoção de Eventos UnB (CESPE) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
Considere que o ácido nítrico (HNO3) comercial seja disponibilizado na forma de uma solução aquosa com densidade 1,40 g/mL e concentração 65,0% em massa de HNO3. Nesse caso, o volume dessa solução comercial que deve ser misturado à água na preparação de 1.000 mL de uma solução de HNO3 0,10 mol/L é
- A.
10,3 mL.
- B.
2,4 mL.
- C.
4,6 mL.
- D.
6,9 mL.
- E.
8,8 mL.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
Acerca de reações químicas, julgue os próximos itens.
Sais de ácidos fortes e bases fortes, quando dissolvidos em água, produzem uma solução de caráter alcalino, conforme o equilíbrio abaixo.
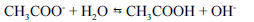
- C. Certo
- E. Errado
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
O produto conhecido como álcool 70, usado como desinfetante e antisséptico, é uma solução com concentração 70% em massa de etanol (C2H5OH) em água (H2O). Considerando que as densidades do etanol, da água e do álcool 70 sejam iguais a 0,79 g/cm3, 1,0 g/cm3 e 0,87 g/cm3, respectivamente, julgue as seguintes afirmações.
I O volume molar da água é superior ao do etanol.
II A concentração do álcool 70, quando expressa em termos da porcentagem volume/volume, é superior a 70%.
III A fração molar de etanol no álcool 70 é superior a 0,5.
IV Para preparar 1.000 mL de álcool 70 são necessários mais do que 700 mL de etanol.
V Na preparação de uma solução de álcool 70, a soma dos volumes de água e etanol utilizados é maior do que o volume de solução obtida.
Assinale a opção correta.
- A.
Apenas os itens II e IV estão certos.
- B.
Apenas os itens II, III e IV estão certos.
- C.
Apenas os itens I, III e V estão certos.
- D.
Apenas os itens II, IV e V estão certos.
- E.
Apenas os itens I e II estão certos.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
Acerca de reações químicas, julgue os próximos itens.
A hidrólise é um equilíbrio entre dois pares conjugados, ácido e base, no qual a água pode participar como um ácido fraco ou uma base fraca. Na hidrólise de íons acetato, a água age como um ácido fraco; na hidrólise do íon amônio, por sua vez, ela age como uma base fraca.
- C. Certo
- E. Errado
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
Considere que uma solução de soro glicosado contenha 5,4 g de glicose (C6H12O6) a cada 100 mL da solução e que sua densidade seja igual a 1,0 g/mL. Com relação a esse soro, julgue as seguintes afirmações.
I A molalidade é igual a 0,30 mol/kg.
II A concentração comum é igual a 5,4 g/L.
III A concentração molar é igual a 0,30 mol/L.
IV A quantidade de água, em 200 mL de solução, é igual a 200 g.
V A quantidade de glicose, em 200 mL de solução, é igual a 0,060 mol.
Assinale a opção correta.
- A.
Apenas os itens I, III e V estão certos.
- B.
Apenas os itens I e II estão certos.
- C.
Apenas os itens I e III estão certos.
- D.
Apenas os itens III e V estão certos.
- E.
Apenas os itens I, II e IV estão certos.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
Acerca de reações químicas, julgue os próximos itens.
A reação de neutralização que ocorre em uma solução contendo ácido clorídrico e hidróxido de bário respeita uma razão estequiométrica de 2:1 de ácido para base.
- C. Certo
- E. Errado
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
O soro glicosado é uma solução aquosa de glicose. Para separar seus componentes, o processo mais adequado é a
- A.
destilação simples.
- B.
destilação fracionada.
- C.
filtração.
- D.
decantação.
- E.
centrifugação.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
Em relação às soluções preparadas rotineiramente em laboratórios químicos e os respectivos procedimentos de preparo, julgue os itens a seguir.
Em soluções, o componente presente em excesso é chamado solvente, enquanto os demais componentes são considerados solutos.
- C. Certo
- E. Errado
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
A tabela periódica dos elementos químicos é uma disposição sistemática desses elementos em função de suas propriedades. Se um elemento X situa-se à direita de um elemento Y, é possível inferir que, considerando átomos neutros, X apresenta maior número de
- A.
prótons e elétrons que Y.
- B.
nêutrons e prótons que Y.
- C.
prótons e massa atômica que Y.
- D.
elétrons e massa atômica que Y.
- E.
nêutrons e elétrons que Y.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2013
Em relação às soluções preparadas rotineiramente em laboratórios químicos e os respectivos procedimentos de preparo, julgue os itens a seguir.
Considere que, em um laboratório, existam dois frascos, A e B, contendo soluções de cloreto de sódio. Se as concentrações dessas soluções forem, respectivamente, iguais a 0,1 g/L e 0,1 % (p/v), as duas soluções possuirão a mesma concentração.
- C. Certo
- E. Errado


