Questões de Química da Fundação Carlos Chagas (FCC)
Lista completa de Questões de Química da Fundação Carlos Chagas (FCC) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Ao se colocar gelo-seco em um béquer contendo uma solução rosa de NaOH 0,1 mol/l com fenolftaleína, verificase que a mesma descora. Isso acontece porque
Dado: Faixa de viragem da fenolftaleína: de pH 8,2 a 10,0
- A.
os íons OH- aumentaram na solução.
- B.
o pH da solução aumentou.
- C.
o pH da solução diminuiu.
- D.
o gelo-seco é constituído por moléculas com acentuada polaridade.
- E.
o gelo-seco sofreu sublimação.
A ureia, (NH2)2CO, pertence à função química
- A.
aldeído.
- B.
amida.
- C.
amina.
- D.
álcool.
- E.
cetona.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Fundação Carlos Chagas (FCC) - 2011
Considere:
I. bronze.
II. bromo.
III. ouro.
IV. gás carbônico.
V. ar.
VI. granito.
Pertencem ao grupo das substâncias puras
- A.
bromo, ouro e gás carbônico.
- B.
bronze, ouro e granito.
- C.
bromo, granito e gás carbônico.
- D.
ar, bronze e gás carbônico.
- E.
ar, ouro e gás carbônico.
Ao iniciar o ensino das transformações químicas, o professor deve considerar que
- A.
todas as transformações químicas são perceptíveis.
- B.
a utilização de experimentos dificulta o entendimento do conceito, pois o aluno não domina os modelos atômicos.
- C.
a representação das equações químicas deve ser o ponto de partida.
- D.
as transformações químicas só podem ser entendidas após o estudo dos modelos atômicos.
- E.
interações entre materiais e energia devem ser consideradas, além da formação de novas substâncias.
O pH de uma água mineral em uma fonte é 5,6. Essa água
- A.
é levemente alcalina.
- B.
contém mais íons H+ do que moléculas H2O.
- C.
contém mais íons H+ em uma concentração entre 10−5 mol/l e 10−6 mol/l.
- D.
contém íons H+ e OH- em uma concentração igual a 1,0 ×10−7 mol/l.
- E.
contém mais íons OH−do que H+.
O soro fisiológico é uma solução de cloreto de sódio a 0,9% (m/v). Um paciente em UTI recebeu 2,0 l de soro fisiológico, o que corresponde a uma quantidade de íons sódio, em mol, de, aproximadamente,
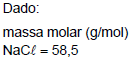
- A.
18,0.
- B.
1,8.
- C.
0,6.
- D.
0,4.
- E.
0,3.
Considere a tabela a seguir.

O composto mais polar é formado por:
- A.
YX
- B.
Z2X
- C.
WX2
- D.
X2
- E.
YX2
Um técnico de laboratório precisa preparar 2,0 l de uma solução de ácido clorídrico (HCl) 0,5 mol/l a partir do ácido concentrado (12,0 mol/l). O volume de ácido concentrado, em litros, que deve ser diluído é, aproximadamente,
- A.
0,02.
- B.
0,03.
- C.
0,04.
- D.
0,06.
- E.
0,08.
Considere os seguintes potenciais de redução, a 25,0°C:

Em uma pilha formada entre alumínio e prata, é correto afirmar que
- A.
o sentido dos elétrons nessa pilha é do alumínio para a prata.
- B.
a equação global da reação da pilha é:

- C.
o alumínio provoca a oxidação da prata na presença de oxigênio.
- D.
a diferença de potencial é − 2,46 V.
- E.
o caráter redutor da prata é maior que o do alumínio.
Considere a relação de ácidos e as respectivas constantes de dissociação representada na tabela abaixo.

Para soluções aquosas com mesma concentração em mol/l desses ácidos, está correto afirmar que
- A.
soluções de ácido fluorídrico e de ácido fórmico têm maior pH.
- B.
o ácido cianídrico é o ácido mais forte.
- C.
o ácido fluorídrico é o ácido mais fraco.
- D.
a reação de ácido fórmico com acetato de sódio forma ácido acético.
- E.
soluções de sais de sódio desses ácidos são ácidas.


