Questões de Química da Fundação Carlos Chagas (FCC)
Lista completa de Questões de Química da Fundação Carlos Chagas (FCC) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Para fechar o ciclo do carbono, o metano utilizado como combustível deve ser obtido a partir
- A.
do GLP.
- B.
do diesel do petróleo.
- C.
da gasolina.
- D.
da decomposição do lixo.
- E.
do carvão mineral.
Atenção: Considere as seguintes reações de combustão do metano, para responder às questões de números 35 e 36.
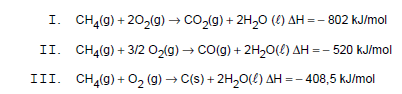
Observando as reações de combustão do metano, podese concluir que, quando comparados aos reagentes, os produtos da reação
- A.
I possuem mais energia armazenada que os da reação II.
- B.
I possuem menos energia armazenada que os da reação III.
- C.
II possuem menos energia armazenada que os da reação I.
- D.
II possuem mais energia armazenada que os da reação III.
- E.
III possuem menos energia armazenada que os da reação I.
Atenção: Considere as seguintes reações de combustão do metano, para responder às questões de números 35 e 36.
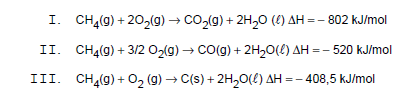
É produzido um gás estufa e um composto venenoso para os seres humanos, respectivamente, nas reações representadas em
- A.
I e II.
- B.
I e III.
- C.
II e III.
- D.
II e I.
- E.
III e II.
No controle da hiperacidez estomacal pode-se utilizar uma solução de comprimido antiácido contendo carbonato e bicarbonato. Nessa solução encontram-se os equilíbrios representados pelas seguintes equações:
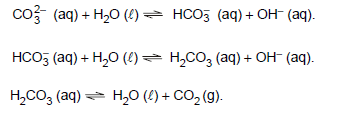
Quando ingerida, essa solução reage com o ácido estomacal e, como consequência, ocorre
- A.
aumento da concentração de íons CO32- (aq).
- B.
desidratação estomacal.
- C.
aumento da concentração de íons H+ (aq).
- D.
liberação de gás.
- E.
diminuição do pH dentro do estômago.
A obtenção do sal da água do mar se dá pela retirada do sal sólido à medida que evapora a água do mar contida em grandes tanques. Nesse processo é obtido sal com teor de mais de 95% em NaCl. Esse alto teor de NaCl é possível porque
- A.
a água do mar tem esse teor de NaCl.
- B.
o NaCl é obtido por cristalização fracionada.
- C.
a temperatura de ebulição da água é maior que a do NaCl.
- D.
a densidade do NaCl é maior que a da água.
- E.
a temperatura de fusão da água é maior que a do NaCl.
Para demonstrar o efeito da superfície de contato e dos catalisadores em uma reação química, pode-se realizar alguns experimentos, como os descritos a seguir:
I. dissolução de um comprimido efervescente em água.
II. decomposição da água oxigenada com dióxido de manganês.
As condições para esses experimentos que demonstram maior rapidez nas reações são:
- A.
comprimido inteiro em I e decomposição na ausência de MnO2em II.
- B.
comprimido triturado em I e decomposição na ausência de MnO2 em II.
- C.
comprimido triturado em I e decomposição na presença de MnO2 em II.
- D.
comprimido inteiro em I e decomposição na presença de MnO2 em II.
- E.
comprimido inteiro em I e decomposição independente do MnO2 em II.
O oxigênio utilizado em hospitais é obtido a partir do ar atmosférico. Nesse processo, o ar é liquefeito para se conseguir a separação de seus componentes, pela destilação fracionada. As condições de temperatura e pressão que permitem a liquefação do ar são
- A.
baixa temperatura e baixa pressão.
- B.
alta temperatura e alta pressão.
- C.
alta temperatura e baixa pressão.
- D.
alta temperatura e pressão atmosférica normal.
- E.
baixa temperatura e alta pressão.
Para demonstrar o processo de tratamento da água de abastecimento público para seus alunos, um professor deve utilizar experimentos que envolvam os seguintes procedimentos, nessa ordem:
- A.
filtração, coagulação e decantação.
- B.
decantação, filtração e coagulação.
- C.
decantação, coagulação e filtração.
- D.
filtração, decantação e coagulação.
- E.
coagulação, decantação e filtração.
Quando se prepara um suco a partir de uma mistura em pó, certamente pode-se desenvolver a articulação da experiência cotidiana com os seguintes conhecimentos químicos:
- A.
modelos atômicos.
- B.
diluição e equilíbrio químico.
- C.
hidrocarbonetos e álcoois.
- D.
dissolução e concentração de soluções.
- E.
partículas constituintes do átomo.
Atenção: Considere os dados abaixo para responder às questões de números 27 e 28.

A liquefação da água está corretamente representada pelo diagrama de energia
- A.

- B.

- C.

- D.

- E.



