Questões de Engenharia Química
Lista completa de Questões de Engenharia Química para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Considerando que a constante universal dos gases seja 8,31451 kPaLK-1mol-1, o valor da pressão exercido por 5,6 g de nitrogênio gasoso em um frasco de volume igual a 200 mL, a 20 ºC, em quilopascal (kPa) é
- A. superior a 5.000 e inferior a 7.000.
- B. superior a 400 e inferior a 700.
- C. superior a 700 e inferior a 1.000.
- D. superior a 1.000 e inferior a 3.000.
- E. superior a 3.000 e inferior a 5.000.
A respeito das propriedades dos gases, assinale a opção correta.
- A. De acordo com o conceito de temperatura crítica, se um recipiente fechado que contenha líquido for continuamente aquecido, será observado apenas o líquido quando o recipiente atingir sua temperatura crítica.
- B. Um gás não pode ser condensado em um líquido devido ao aumento de pressão, a menos que a temperatura esteja acima da temperatura crítica.
- C. O fator de compressibilidade de um gás real é igual a 1 em quaisquer condições de temperatura e pressão.
- D. À baixa pressão, qualquer gás apresenta o parâmetro fator de compressibilidade positivo, o que está relacionado à dominância de interações repulsivas entre suas moléculas.
- E. A variação da temperatura afeta diretamente a velocidade de difusão de moléculas gasosas, por isso moléculas de amostras de gás em alta temperatura apresentam maior coeficiente de difusão que moléculas de amostras de gás em baixa temperatura.
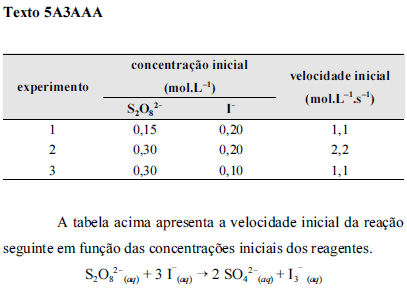
Considerando-se que k seja a constante de velocidade da reação apresentada no texto 5A3AAA, é correto afirmar que a lei de velocidade para essa reação é
- A.

- B.

- C.

- D.

- E.

A relação correta entre as taxas de variações das concentrações das espécies envolvidas na reação apresentada no texto 5A3AAA, desconsiderando a ocorrência de intermediários, é
- A.

- B.

- C.

- D.

- E.

A respeito da reação elementar 2A (g) 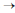 produto, assinale a opção correta.
produto, assinale a opção correta.
- A. A remoção do produto, durante a reação, favorecerá a cinética da reação porque isso propiciará um aumento da fração de colisões efetivas entre as moléculas do reagente A.
- B. A adição de um catalisador favorecerá a cinética da reação porque ele fornecerá energia à espécie reagente, aumentando assim o número total de colisões das moléculas do reagente A.
- C. A adição de um gás inerte favorecerá a cinética da reação porque ele cria um caminho reacional alternativo com menor energia de ativação.
- D. Um aumento de temperatura favorecerá a cinética da reação, principalmente porque ocorrerá um aumento da fração de colisões efetivas entre as moléculas do reagente A.
- E. Um aumento da pressão parcial do reagente A favorecerá a cinética da reação porque será aumentada a fração de colisões efetivas entre as moléculas do reagente A.
Ainda em relação à reação elementar 2A (g)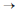 produto, assinale a opção cujo gráfico representa o comportamento da concentração da espécie reagente A em função do tempo.
produto, assinale a opção cujo gráfico representa o comportamento da concentração da espécie reagente A em função do tempo.
- A.

- B.

- C.

- D.

- E.

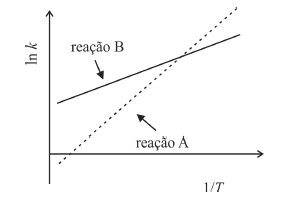
A partir da equação de Arrhenius e do gráfico precedente, correspondente ao logaritmo neperiano da constante de velocidade (k) em função do inverso da temperatura (T), em graus kelvin, para as reações A e B, é correto afirmar que a reação A apresenta energia de ativação
- A. inferior à da reação B e fator de frequência superior.
- B. superior à da reação B e o mesmo fator de frequência.
- C. e fator de frequência inferiores aos da reação B.
- D. e fator de frequência superiores aos da reação B.
- E. superior à da reação B e fator de frequência inferior.
Considerando-se que o teor do isótopo carbono-14 (14C) encontrado em um artefato de madeira seja de 25% do valor presente nos organismos vivos e que a meia-vida do isótopo 14C seja de 5.730 anos, é correto concluir que o referido artefato foi confeccionado a partir de uma árvore cortada há
- A. 22.920 anos.
- B. 716,25 anos.
- C. 1.432,5 anos.
- D. 5.730 anos.
- E. 11.460 anos.
O ácido sulfúrico (H2SO4), em água, ioniza completamente um de seus hidrogênios e, parcialmente, o outro. Considerando-se que a constante de hidrólise da água seja igual a 1,0 × 10-14 e que 0,30 seja valor aproximado para log 2, é correto afirmar que uma solução aquosa de H2SO4 com concentração analítica igual a 0,010 mol/L e comportamento ideal apresentará
- A. pOH inferior a 12,0.
- B. pOH superior a 12,3.
- C. pOH superior a 12,0 e inferior a 12,3.
- D. pH superior a 12,3.
- E. pH superior a 12,0 e inferior a 12,3.
Soluções aquosas dos sais cianeto de sódio (NaCN) e cloreto de amônio (NH4Cl) apresentam pH
- A. ácido.
- B. básico.
- C. básico e ácido, respectivamente.
- D. ácido e básico, respectivamente.
- E. neutro.


