Questões de Engenharia Química do ano 2016
Lista completa de Questões de Engenharia Química do ano 2016 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Ainda em relação à reação elementar 2A (g) produto, assinale a opção cujo gráfico representa o comportamento da concentração da espécie reagente A em função do tempo.
produto, assinale a opção cujo gráfico representa o comportamento da concentração da espécie reagente A em função do tempo.
- A.

- B.

- C.

- D.

- E.

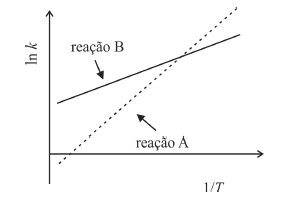
A partir da equação de Arrhenius e do gráfico precedente, correspondente ao logaritmo neperiano da constante de velocidade (k) em função do inverso da temperatura (T), em graus kelvin, para as reações A e B, é correto afirmar que a reação A apresenta energia de ativação
- A. inferior à da reação B e fator de frequência superior.
- B. superior à da reação B e o mesmo fator de frequência.
- C. e fator de frequência inferiores aos da reação B.
- D. e fator de frequência superiores aos da reação B.
- E. superior à da reação B e fator de frequência inferior.
Considerando-se que o teor do isótopo carbono-14 (14C) encontrado em um artefato de madeira seja de 25% do valor presente nos organismos vivos e que a meia-vida do isótopo 14C seja de 5.730 anos, é correto concluir que o referido artefato foi confeccionado a partir de uma árvore cortada há
- A. 22.920 anos.
- B. 716,25 anos.
- C. 1.432,5 anos.
- D. 5.730 anos.
- E. 11.460 anos.
O ácido sulfúrico (H2SO4), em água, ioniza completamente um de seus hidrogênios e, parcialmente, o outro. Considerando-se que a constante de hidrólise da água seja igual a 1,0 × 10-14 e que 0,30 seja valor aproximado para log 2, é correto afirmar que uma solução aquosa de H2SO4 com concentração analítica igual a 0,010 mol/L e comportamento ideal apresentará
- A. pOH inferior a 12,0.
- B. pOH superior a 12,3.
- C. pOH superior a 12,0 e inferior a 12,3.
- D. pH superior a 12,3.
- E. pH superior a 12,0 e inferior a 12,3.
Soluções aquosas dos sais cianeto de sódio (NaCN) e cloreto de amônio (NH4Cl) apresentam pH
- A. ácido.
- B. básico.
- C. básico e ácido, respectivamente.
- D. ácido e básico, respectivamente.
- E. neutro.

A partir das informações do texto 5A3BBB e considerando que a solução do ácido acético apresente comportamento ideal, é correto afirmar que o grau de ionização do ácido acético em uma solução aquosa a 0,010 mol/L, na temperatura T0, será igual a
- A. 40%.
- B. 0,5%.
- C. 2%.
- D. 4%.
- E. 16%.

A partir das informações apresentadas no texto 5A3BBB e considerando que as soluções envolvidas apresentem comportamento ideal, assinale a opção que apresenta, respectivamente, um sal adequado para a preparação de uma solução tampão com o ácido acético e a faixa de pH em que se encontrará a referida solução tampão, na temperatura T0, se ela for preparada empregando-se as mesmas concentrações, em quantidade de matéria, do sal e do ácido.
- A. acetato de sódio; entre 4 e 5
- B. cloreto de sódio; entre 3 e 4
- C. cloreto de sódio; entre 4 e 5
- D. acetato de sódio; entre 2 e 3
- E. acetato de sódio; entre 3 e 4
A remoção de metais pesados em efluentes líquidos pode ser realizada por meio da precipitação do metal, empregando-se um ânion adequado. Por exemplo, a concentração de Cd2+ em água pode ser reduzida pela precipitação, em meio alcalino, de Cd(OH)2. Nesse sentido, considerando-se que o produto de solubilidade (Kps) do Cd(OH)2 seja igual a 1,0 × 10-14, é correto concluir que a concentração residual de Cd2+ (aq) em uma solução aquosa com comportamento ideal e pH igual a 10 será igual a
- A. 1,0 × 10-4 mol/L.
- B. 1,0 × 10-5 mol/L.
- C. 1,0 × 10-6 mol/L.
- D. 1,0 × 10-7 mol/L.
- E. 1,0 × 10-3 mol/L.
 De acordo com as informações do texto 5A3CCC, se, em determinado instante, na temperatura T0, as pressões parciais de N2O4 (g) e NO2 (g) dentro de uma câmara forem iguais a 0,16 bar e 0,80 bar, respectivamente, então
De acordo com as informações do texto 5A3CCC, se, em determinado instante, na temperatura T0, as pressões parciais de N2O4 (g) e NO2 (g) dentro de uma câmara forem iguais a 0,16 bar e 0,80 bar, respectivamente, então
- A. a reação não se encontrará em equilíbrio, mas as velocidades das reações direta e inversa serão iguais e diferentes de zero.
- B. a reação se encontrará em equilíbrio, e a velocidade tanto da reação direta quanto da reação inversa será igual a zero.
- C. a reação se encontrará em equilíbrio, e as velocidades das reações direta e inversa serão iguais.
- D. a reação não se encontrará em equilíbrio, e a velocidade da reação direta será superior à da reação inversa.
- E. a reação não se encontrará em equilíbrio, e a velocidade da reação inversa será superior à da reação direta.
 De acordo com as informações do texto 5A3CCC, as modificações que, do ponto de vista do equilíbrio químico, favorecem a formação do NO2 (g) a partir da reação apresentada são:
De acordo com as informações do texto 5A3CCC, as modificações que, do ponto de vista do equilíbrio químico, favorecem a formação do NO2 (g) a partir da reação apresentada são:
- A. pressurização do sistema e aumento da temperatura.
- B. pressurização do sistema e adição de um catalisador.
- C. despressurização do sistema e adição de um catalisador.
- D. adição de um gás inerte e diminuição da temperatura.
- E. despressurização do sistema e aumento da temperatura.


