Questões de Engenharia Química da Fundação Carlos Chagas (FCC)
Lista completa de Questões de Engenharia Química da Fundação Carlos Chagas (FCC) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
A espectroscopia de absorção do infravermelho é uma técnica utilizada para o monitoramento ambiental de
- A.
amônia.
- B.
gás sulfídrico.
- C.
ozônio.
- D.
material particulado.
- E.
vapor d'água.
A análise de 250 mL de uma amostra de água contaminada com HCl acusou pH = 4. A quantidade máxima de CaCO3 (s), em gramas, que pode reagir com essa amostra, segundo a equação
CaCO3 (s) + H+ (aq) Ca2+ (aq) + HCO _ 3 (aq)
é, aproximadamente
Dado: massa molar (g/mol) CaCO3 = 100
- A.
2,5 × 10−5
- B.
1,0 × 10−4
- C.
2,5 × 10−3
- D.
2,5 × 10−2
- E.
1,0 × 10−1
Na análise de fósforo em águas naturais utiliza-se o método espectrofotométrico do Azul de Molibdênio. Para amostras muito diluídas recomenda-se, no sentido de melhorar a sensibilidade do método,
I. o aumento do caminho óptico.
II. a utilização do comprimento de onda auxiliar.
III. a utilização do método da adição de padrão.
Está correto o que se afirma APENAS em
- A.
I.
- B.
II.
- C.
III.
- D.
I e II.
- E.
I e III.
Na reação global que ocorre numa bateria de automóvel, conforme a equação
Pb (s) + PbO2 (s) + 2H2SO4 (aq) 2PbSO4 (s) + 2H2O (l)
o número de elétrons transferidos de 1 mol de átomos Pb (s) para PbO2 (s)
é, aproximadamente,Dado:
Constante de Avogadro: 6,0 × 1023
- A.
6,0 × 1023
- B.
1,2 × 1024
- C.
1,8 × 1024
- D.
2,4 × 1024
- E.
3,0 × 1024
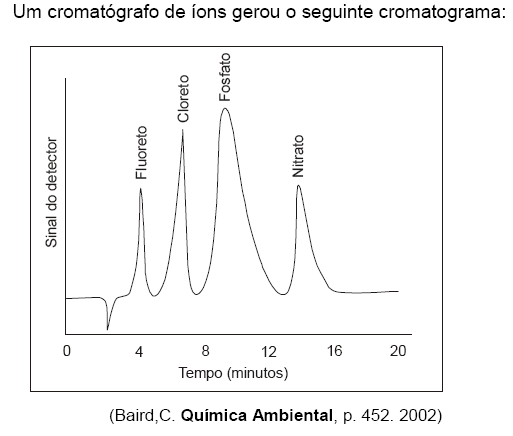
As informações obtidas permitem concluir que
I. a concentração do íon fosfato é diretamente proporcional à altura do pico.
II. o íon de maior afinidade com a fase móvel é o fluoreto.
III. o íon nitrato possui maior tempo de retenção. Está correto o que se afirma em
- A.
I, II e III.
- B.
I e II, apenas.
- C.
II, apenas.
- D.
III, apenas.
- E.
II e III, apenas.
Abaixo está representado um espectro de 1H-RNM de uma bebida alcoólica que contém 40% de etanol e água.
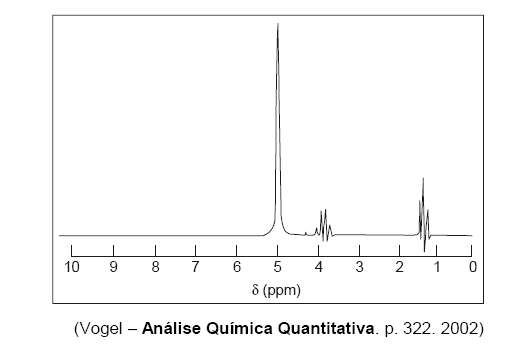
Sabendo-se que os outros componentes da bebida estão em concentrações inferiores ao limite de detecção da técnica, o sinal em 5,0 ppm indica
- A.
os grupos CH2 e CH3 do etanol.
- B.
os grupos OH da água e do etanol.
- C.
o grupo CH2 do etanol.
- D.
o grupo CH3 do etanol.
- E.
o grupo CC do etanol.
Um técnico de laboratório preparou um litro das seguintes soluções:
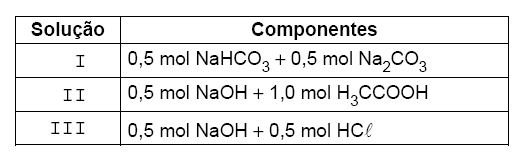
Dessas soluções, apresenta propriedade tampão APENAS
Dados: constantes de dissociação (a 20 °C) H2CO3: k1 = 1,5 × 10−7 k2 = 7,0 × 10−11 NaOH = 4,0 H3CCOOH = 1,6 × 10−5 HCl = 107
- A.
I.
- B.
II.
- C.
III.
- D.
I e II.
- E.
II e III.
Na determinação da pureza de uma amostra de calcita, CaCO3, por determinação gravimétrica, foi encontrado 90% de pureza. Assim, para uma amostra de 10,00 g de calcita, foi encontrado, em gramas de CaO, após calcinação a 800 °C,
Dado: massas molares (g/mol) Ca = 40; C = 12; O = 16
- A.
2,10
- B.
4,02
- C.
5,04
- D.
8,35
- E.
9,12
A tabela abaixo mostra os resultados de três métodos de análise de fósforo em águas naturais, testados em vários laboratórios.
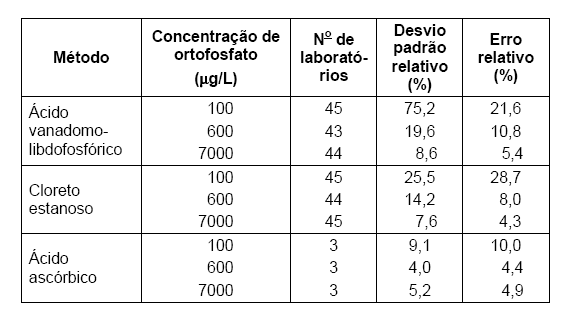
O método para análise de fósforo que possui maior precisão é
- A.
ácido vanadomolibdofosfórico, para concentração de 100 μg/L.
- B.
ácido vanadomolibdofosfórico, para concentração de 600 μg/L.
- C.
cloreto estanoso, para concentração de 100 μg/L.
- D.
cloreto estanoso, para concentração de 7000 μg/L.
- E.
ácido ascórbico, para concentração de 7000 μg/L.
O pH mais elevado, no ponto estequiométrico de uma titulação, será observado na reação de NaOH 0,1 mol/L com uma solução de mesma concentração de
- A.
HCl (pKa = −7)
- B.
HNO3 (pKa = −2)
- C.
HCOOH (pKa = 3,75)
- D.
H3CCOOH (pKa = 4,76)
- E.
H3CCH2COOH (pKa = 4,88)


