Questões de Química do ano 2008
Lista completa de Questões de Química do ano 2008 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
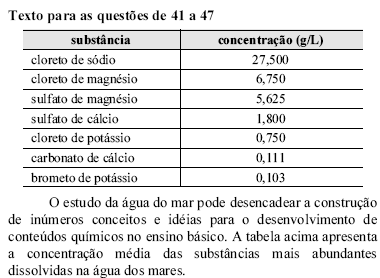
A respeito das propriedades coligativas, é correto afirmar que, sob uma pressão de 1 atm,
- A.
o congelamento da água do mar tem início em uma temperatura maior que a da água pura.
- B.
um peixe de um rio cuja água apresenta concentração salina menor que a da água do mar, quando colocado no mar, cuja água é hipertônica em relação às suas células, absorverá água por osmose, inchando-se.
- C.
a água do mar entra em ebulição a uma temperatura superior à da água pura.
- D.
não há diferença entre as propriedades da água do rio ou do mar, pois, em ambas as situações, a água está presente em maior quantidade e, por isso, suas propriedades prevalecem nessas misturas.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
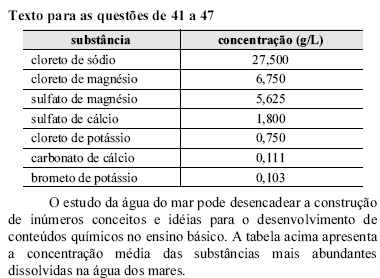
Considerando que o coeficiente de solubilidade do cloreto de sódio em água, a 20 ºC, é igual a 360 g/kg, é correto afirmar que a água do mar em relação a este sal é uma
- A.
solução saturada.
- B.
solução supersaturada.
- C.
solução insaturada.
- D.
mistura e, portanto, não pode ser considerada uma solução.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
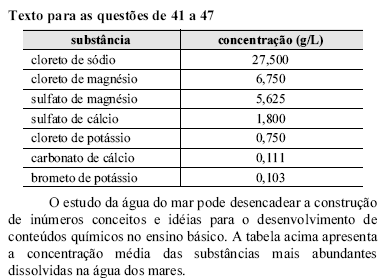 Considerando a tabela apresentada e que as massas molares do potássio e do cloro são, respectivamente, 40 g/mol e 35,5 g/mol, é correto deduzir que a concentração em quantidade de matéria de cloreto de potássio na água do mar é
Considerando a tabela apresentada e que as massas molares do potássio e do cloro são, respectivamente, 40 g/mol e 35,5 g/mol, é correto deduzir que a concentração em quantidade de matéria de cloreto de potássio na água do mar é
- A.
inferior ou igual a 0,001 mol/L.
- B.
superior a 0,001 mol/L inferior a 0,011 mol/L.
- C.
superior a 0,011 mol/L inferior a 0,11 mol/L.
- D.
superior a 0,1 mol/L.
Química - Química, Tecnologia, Sociedade e Meio Ambiente - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
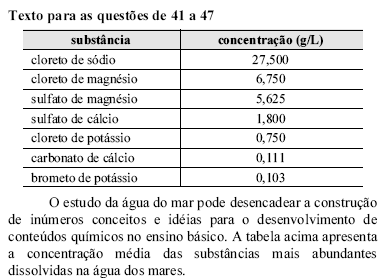
Considerando apenas os sais apresentados na tabela, é correto concluir que se encontram na água do mar átomos dos elementos pertencentes aos grupos
- A.
dos halogênios, dos calcogêneos e dos metais alcalinos, metais alcalino terrosos e de transição, além do hidrogênio.
- B.
dos elementos representativos, nos quais os subníveis mais energéticos são o s ou o p.
- C.
dos halogênios, dos calcogêneos, da família do carbono, da família do nitrogênio e dos metais de transição.
- D.
dos elementos representativos e dos metais de transição.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
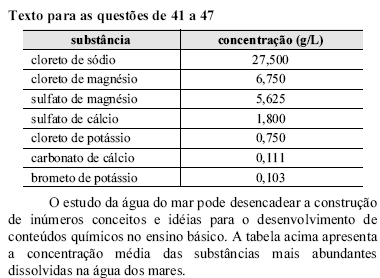
Com base na tabela, assinale a opção em que os cátions e ânions apresentados estão presentes na água do mar.
- A.

- B.

- C.

- D.

Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
O biodísel, assim chamado por ser um combustível derivado de fontes renováveis vegetais, pode ser produzido por meio de diferentes técnicas, entre as quais se destacam a esterificação, a transesterificação e o craqueamento térmico e(ou) catalítico. Nessas técnicas de produção, são utilizados como matéria-prima óleos e gorduras extraídos de espécies vegetais (nativas ou não) existentes no Brasil, tais como a soja, o dendê, a mamona.
A tabela abaixo resume algumas propriedades físicoquímicas de certos óleos vegetais e de dois tipos de óleo dísel.
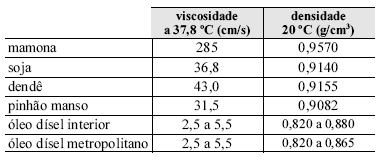
Considerando as informações do texto e os dados da tabela, assinale a opção correta com relação ao biodísel.
- A.
A viscosidade e a densidade têm papel importante no bombeamento e no fluxo de combustíveis no interior do motor. Logo, considerando-se apenas esses dois fatores, conclui-se que o Brasil deve investir no cultivo de mamona, que parece ser a mais indicada como matéria-prima do biodísel.
- B.
As diferenças nos valores de viscosidade indica que, quanto mais fracas forem as forças de atração entre as moléculas, maiores serão suas viscosidades.
- C.
O aumento de insaturações em uma cadeia carbônica aumenta o estado de agregação do material devido à elevação das forças intermoleculares.
- D.
O biodísel é um combustível de "queima limpa", por ser essencialmente isento de compostos sulfurados, nitrogenados e aromáticos, sendo considerado menos impactante ao meio ambiente que o dísel de petróleo
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
O clorofórmio, CHCl3 , empregado como solvente para produtos naturais, fumigante (para solo), anestésico e droga, é produto altamente tóxico ao organismo humano. Considerando que o valor da densidade desse produto é 1,5 g/mL a 20 ºC, calcule o volume necessário dessa substância para preparar 500 mL de uma solução com concentração em massa correspondente a 12,0 g/L e assinale a opção com a correta indicação desse volume e da vidraria que deve ser utilizada no preparo dessa solução, de forma que o erro percentual associado à medida seja o menor possível.
- A.
O volume é de 4,00 mL e deve ser medido em pipeta graduada de 5 mL, cuja menor divisão da vidraria é o 0,1 mL.
- B.
O volume é de 4,00 mL e deve ser medido em proveta de 5 mL, cuja menor divisão da vidraria é 0,5 mL.
- C.
O volume é de 9,00 mL e deve ser medido em proveta de 10 mL, cuja menor divisão é 0,5 mL.
- D.
O volume é de 9,00 mL e deve ser medido em pipeta graduada de 10 mL, cuja menor divisão é 0,1 mL.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
As espectrometrias de emissão por plasma, arco e centelha oferecem muitas vantagens em relação às espectrometrias de chama e aos métodos de absorção eletrotérmica. Acerca desse assunto, assinale a opção correta.
- A.
Na emissão por plasma, há baixa interferência entre os elementos, conseqüência direta da alta temperatura utilizada nesse tipo de análise.
- B.
Utilizando-se a emissão por chama, podem-se obter espectros para dúzias de elementos simultaneamente, o que não é possível com as fontes de plasma, pois, nestas, as condições ótimas de excitação variam muito de elemento para elemento.
- C.
Os espectros de emissão obtidos por fontes de chama são, na maioria das vezes, muito complexos, sendo constituídos de centenas ou, às vezes, milhares de linhas.
- D.
Fontes de plasma pouco energéticas permitem a determinação de baixas concentrações de elementos que tendem a formar compostos refratários, como aqueles altamente resistentes à decomposição térmica.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
A teoria da ligação de valência (TLV) permite explicar como são associados os ligantes de um metal em um complexo, com base nos orbitais que participam dessas ligações coordenadas, além de fornecer o tipo de hibridação e a geometria do composto. Considerando que Z(H) = 1; Z(N) = 7; Z(F) = 9; Z(CR) = 17; Z(Co) = 27; Z(Ni) = 28; Z(Pt) = 78; assinale a opção que apresenta uma associação correta entre a fórmula do complexo, o tipo de hibridação.
- A.
[Co(NH3 )6 ]Cl3 — d2 sp3
- B.
[NiCR4 ]2- — sp3
- C.
[CoF6 ]3- — sp2 d
- D.
[PtCR4 ]2- — sp2 d
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Ao observar, na prateleira de um supermercado, uma garrafa de 750 mL de um vinho que continha, segundo informações do rótulo, 12,0% em massa de álcool, um consumidor teve a curiosidade de saber o conteúdo calórico nutricional dessa bebida.
Nessa situação, considerando-se que o calor de combustão do etanol, a 25 ºC, é -1.380 kJ/mol, que a densidade do vinho é igual a 0,80 g/mL e que 1 cal = 4,18 J, é correto afirmar que o conteúdo calórico nutricional contido em 750 mL desse vinho é
- A.
inferior a 300 kcal.
- B.
superior ou igual a 300 kcal e inferior a 400 kcal.
- C.
superior ou igual a 400 kcal e inferior a 500 kcal.
- D.
superior a 500 kcal.


