Questões de Química do ano 2008
Lista completa de Questões de Química do ano 2008 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
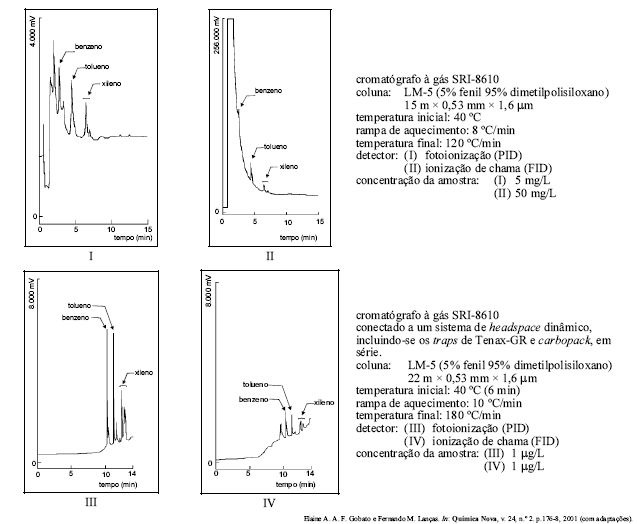
Entre os métodos modernos de análise química, a cromatografia ocupa lugar de merecido destaque no que se refere à separação, identificação e quantificação de espécies químicas. Soluções contendo benzeno, tolueno e xileno foram preparadas em metanol e injetadas em um cromatógrafo a gás modelo SRI-8610. As figuras acima mostram alguns cromatogramas obtidos por essa técnica, seguidos de informações a respeito das condições de corrida cromatográficas. Com base nas figuras e nas informações apresentadas, assinale a opção correta.
- A.
O sinal obtido pelo detector de fotoionização (PID) foi maior que o obtido pelo detector de ionização de chama (FID), para amostras com a mesma concentração, por ser aquele mais sensível que este.
- B.
O pico que antecede o do benzeno, nos cromatogramas I e II, é relativo a interferentes da amostra injetada.
- C.
C O cromatograma II teria seus picos mais bem resolvidos se a concentração da amostra fosse de 5 mg/L.
- D.
Os cromatogramas III e IV apresentam picos mais bem resolvidos devido ao fato de a técnica de headspace ser apropriada para analisar compostos com elevadas concentrações.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Suponha que os gases CO2 , CO e C2 emitidos por uma indústria tenham porcentagens volumétricas iguais a 12%, 1,5% e 3,0%, respectivamente, e considere que o valor da constante de equilíbrio (KP ) para a reação 2 CO2 (g)  2 CO (g) + O 2 (g) seja 1,00 × 10-3 .
2 CO (g) + O 2 (g) seja 1,00 × 10-3 .
Com base nesses dados, assinale a opção em que se descreve corretamente esse sistema nas condições estabelecidas.
- A.
A reação não está em equilíbrio e, para que este seja alcançado, as concentrações de CO e O2 devem diminuir e(ou) a de CO2 deve aumentar.
- B.
A reação não está em equilíbrio e, para que este seja alcançado, a concentração de CO2 deve diminuir e(ou) as de CO e O2 devem aumentar.
- C.
O equilíbrio da reação só será alcançado se houver aeração do sistema.
- D.
A reação está em equilíbrio e a emissão dessa indústria não contribui significativamente para o aquecimento global.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Texto para as questões de 21 a 23
João, bacharel em química, foi contratado para reativar o laboratório de controle de qualidade e de pesquisa de uma empresa. Ao entrar no laboratório, João encontrou uma grande quantidade de frascos com material químico, alguns identificados como resíduos e outros, não. Resolveu iniciar seu trabalho zerando o passivo ali existente.
Considere-se que João tenha se deparado, no laboratório, com o desafio de tratar resíduos que contivessem íons cianeto e que, para proceder a esse tratamento, ele tenha feito uso de hipoclorito de sódio para oxidar o cianeto, dada a pequena quantidade desse resíduo. Considere-se, também, que tenha restado um excesso de hipoclorito na solução e que Ka (HlRO) = 3,2 × 10-8 . Nessa situação, é correto inferir que o pH da solução, após esse tratamento, é
- A.
ácido, devido à dissociação do ácido hipocloroso.
- B.
ácido, devido à dissociação do ácido perclórico.
- C.
básico, devido à hidrólise do hipoclorito.
- D.
neutro.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Texto para as questões de 21 a 23
João, bacharel em química, foi contratado para reativar o laboratório de controle de qualidade e de pesquisa de uma empresa. Ao entrar no laboratório, João encontrou uma grande quantidade de frascos com material químico, alguns identificados como resíduos e outros, não. Resolveu iniciar seu trabalho zerando o passivo ali existente.
Considere-se, na situação hipotética descrita, que João tenha encontrado no laboratório 4 frascos que continham, no total, 3 L de uma solução neutra de sulfato cúprico e que ele tenha resolvido recuperar os íons Cu2+ eletrolisando a solução com eletrodos inertes, durante 193 min, com uma corrente média de 2,5 mA. Considere-se, ainda, que o processo reacional global seja representado pela equação química
2 Cu2+ (aq) + 2 H2O (l) → 2 Cu (s) + O2 (g) + 4 H+ (aq) e que o cobre metálico seja a única espécie a ser depositada no eletrodo e, ainda, que a constante de Faraday vale 96.500 C/mol. Nessa situação, é correto concluir que o pH da solução final é
- A.
inferior ou igual a 1.
- B.
superior a 1 e inferior ou igual a 4.
- C.
superior a 4 e inferior ou igual a 7.
- D.
superior a 7.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Texto para as questões de 21 a 23
João, bacharel em química, foi contratado para reativar o laboratório de controle de qualidade e de pesquisa de uma empresa. Ao entrar no laboratório, João encontrou uma grande quantidade de frascos com material químico, alguns identificados como resíduos e outros, não. Resolveu iniciar seu trabalho zerando o passivo ali existente.
Considerando que, na situação hipotética descrita, as soluções residuais encontradas no laboratório estavam perfeitamente identificadas e não continham outras substâncias, além das já identificadas, e, ainda, que
Eºred (Ag+ ) = 0,799 V; Eºred (Cu2+ ) = 0,337 V;
Kps [Cr(OH)3 ] = 3,0 × 10-29 ; Kps [PbS] = 3 × 10-28 , julgue os itens a seguir, no que se refere aos procedimentos adequados a essa situação.

- A.
1.
- B.
2.
- C.
3.
- D.
4.
No processo de validação de um método analítico, parâmetros como Especificidade, Seletividade, Precisão e Limite de Detecção, dentre outros, são determinados para garantir o atendimento às exigências das aplicações analíticas e, conseqüentemente, assegurar a confiabilidade dos resultados obtidos. Sobre esses parâmetros foram feitas as afirmativas a seguir.
I - A Especificidade define a capacidade do método em detectar o analito de interesse na presença de outros componentes da matriz; a Seletividade refere-se à capacidade de detecção de substâncias.
II - O parâmetro que avalia a proximidade entre várias medidas efetuadas na mesma amostra é a Precisão do processo analítico. Usualmente, é expressa como desvio padrão, variância ou coeficiente de variação (CV) de diversas medidas.
III - A menor concentração do analito que pode ser detectada, mas não necessariamente quantificada, sob condições experimentais estabelecidas, constitui o Limite de Detecção do método.
Está(ão) correta(s) a(s) afirmativa(s)
- A.
I, apenas.
- B.
II, apenas.
- C.
I e II, apenas.
- D.
II e III, apenas.
- E.
I, II e III.
Um Programa de Gerenciamento de Resíduos de Laboratório (PGRQ) pode ser considerado como um Programa de Boas Práticas e Segurança em Laboratórios, pois diminui a exposição dos trabalhadores aos produtos potencialmente perigosos e promove melhoria da qualidade ambiental. Dentre as ações a seguir, qual a que NÃO corresponde às realizadas num PGRQ?
- A.
Armazenar todos os resíduos coletados em local fechado, completamente isolado e sem ventilação, para evitar o contato do material com o ar.
- B.
Concentrar os resíduos com o objetivo de reduzir o volume de descarte e armazenamento.
- C.
Implantar sistemas de coleta, tratamento e lavagem de gases e vapores gerados na capelas.
- D.
Realizar o inventário e a classificação dos resíduos em função de suas características físicas e químicas.
- E.
Segregar os resíduos diretamente na fonte em que são gerados, evitando a mistura de resíduos perigosos.
A Cromatografia é uma técnica utilizada para a separação dos componentes de uma mistura. A separação cromatográfica é baseada na distribuição dos componentes entre uma fase estacionária e uma fase móvel. Dentre os principais métodos cromatográficos pode-se destacar a cromatografia de camada delgada (CCD), a cromatografia gasosa (CG) e cromatografia líquida de alta eficiência (CLAE). Sobre esses métodos cromatográficos, é INCORRETO afirmar que
- A.
uma das desvantagens da CLAE é que ela jamais pode ser utilizada para determinar mais de uma substância em uma mesma amostra.
- B.
as separações em CLAE podem se dar por adsorção, partição (fase normal e reversa) ou ambas.
- C.
a CCD é uma técnica de adsorção líquido–sólido, em que a separação se dá pela diferença de afinidade dos componentes de uma mistura pela fase estacionária.
- D.
a CG é útil para a determinação de espécies voláteis, enquanto a CLAE é útil para a determinação de espécies polares.
- E.
o principal mecanismo de separação da CG está baseado na partição dos componentes da amostra entre a fase móvel gasosa e a fase estacionária líquida.
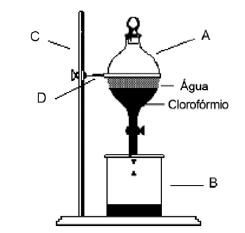
Qual das considerações a seguir NÃO se refere ao sistema de separação apresentado na figura?
- A.
A primeira fração da mistura a deixar o funil pertence ao líquido com menor densidade.
- B.
A água e o clorofórmio são imiscíveis e formam um sistema bifásico.
- C.
O sistema é utilizado para a separação de misturas heterogêneas.
- D.
O sistema é o de Decantação Fracionada.
- E.
Os equipamentos que compõem o sistema são: A = funil de decantação; B = becher; C = haste universal; D = argola (para suporte do funil).
De acordo com a Lei de Beer, a Absorbância (A) de um meio pode ser obtida conforme a equação:
- A.
A = - log a, onde a = absortividade
- B.
A = - log T, onde T = Transmitância
- C.
A = + log T, onde T = Transmitância
- D.
A = + log
 onde
onde  = absortividade molar
= absortividade molar - E.
A = - log b, onde b = caminho ótico


