Questões de Química do ano 2008
Lista completa de Questões de Química do ano 2008 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Considerando que a faixa de viragem de pH para o vermelho de metila é de 4,4 a 6,2 e, para o vermelho de cresol, de 1,2 a 2,8, assinale a opção que apresenta ação que gera apenas erros indeterminados de análise.
- A.
Em uma análise volumétrica em que o vermelho de cresol seria o indicador de escolha, utiliza-se vermelho de metila.
- B.
Em uma análise gravimétrica de Fe(III), usa-se ácido clorídrico que contém impurezas de ferro.
- C.
Durante um processo de síntese, pesa-se um cadinho imediatamente após este ter sido retirado de uma estufa a 150 ºC.
- D.
Manuseia-se uma pipeta de forma distinta durante testes em triplicata.
Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
A equação a seguir representa a oxidação da magnetita (Fe3 O4 ) em hematita (Fe2 O3 ). 2 Fe3 O4 (s) + ½ O2 (g) 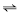 3 Fe2 O3 (s)
3 Fe2 O3 (s) 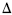 Hº f = -235,8 kJ/mol Considere-se que a reação acima se processe, em equilíbrio, em um sistema fechado à temperatura de 298 K e pressão de 1 atm. Nessa situação, caso o volume do recipiente onde se encontram as substâncias reagentes, sob condições isotérmicas, diminua, é correto afirmar que
Hº f = -235,8 kJ/mol Considere-se que a reação acima se processe, em equilíbrio, em um sistema fechado à temperatura de 298 K e pressão de 1 atm. Nessa situação, caso o volume do recipiente onde se encontram as substâncias reagentes, sob condições isotérmicas, diminua, é correto afirmar que
- A.
haverá mais hematita após o restabelecimento do equilíbrio.
- B.
haverá mais magnetita após o restabelecimento do equilíbrio.
- C.
o
 G será maior que zero para o processo de restabelecimento do equilíbrio.
G será maior que zero para o processo de restabelecimento do equilíbrio. - D.
a constante de equilíbrio da reação decrescerá.
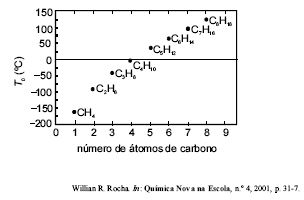
Considerando a figura acima, que mostra a variação da temperatura de ebulição de vários hidrocarbonetos lineares em função do número de átomos de carbono em suas moléculas, assinale a opção que apresenta uma explicação correta para as diferenças nas temperaturas de ebulição dessas substâncias.
- A.
Uma elevação da massa molar das substâncias provoca diminuição na temperatura de ebulição
- B.
As forças eletrostáticas associadas com as interações entre as moléculas representadas no gráfico são descritas matematicamente pela Lei de Coulomb.
- C.
Quanto maior o comprimento da ligação covalente, maior o ponto de ebulição da molécula que a contém.
- D.
Para compostos apolares, as polarizabilidades das duas moléculas em contato determinam a força de tal interação, visto que uma molécula afeta a densidade eletrônica da outra, e essa força de interação, por sua vez, determina a temperatura de ebulição.
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
A sacarose, composta por uma molécula de 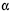 -D-glicose e uma de
-D-glicose e uma de 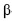 -D-frutose, tendo os átomos de carbono C1 da glicose e C2 da frutose participação na ligação glicosídica, é comumente conhecida como açúcar, sendo extraída para distribuição comercial da cana-de-açúcar (Sacharum officinarum) e da beterraba (Beta vulgaris). No estômago de mamíferos, a sacarose é digerida por hidrólise ácida, que é o mesmo processo usado, em laboratório, para se obterem glicose e frutose. Estas, resultantes da hidrólise da sacarose, são rapidamente absorvidas no intestino delgado, penetrando na corrente sanguínea. Por esses motivos, a sacarose é uma fonte de energia química rápida (com um conteúdo calórico de 17 kJ/g) e causa, logo após sua ingestão, a subida dos níveis sanguíneos de glicose. A partir do gráfico a seguir (ln k × 1/T), em que k representa a constante de velocidade da reação e T, a temperatura absoluta, é possível determinar um dos parâmetros de Arrhenius, isto é, a energia de ativação, Ea , para a hidrólise ácida da sacarose. Considere-se que a velocidade da reação dependa exclusivamente da concentração de sacarose e observe-se que dois pontos da reta são mostrados no gráfico.
-D-frutose, tendo os átomos de carbono C1 da glicose e C2 da frutose participação na ligação glicosídica, é comumente conhecida como açúcar, sendo extraída para distribuição comercial da cana-de-açúcar (Sacharum officinarum) e da beterraba (Beta vulgaris). No estômago de mamíferos, a sacarose é digerida por hidrólise ácida, que é o mesmo processo usado, em laboratório, para se obterem glicose e frutose. Estas, resultantes da hidrólise da sacarose, são rapidamente absorvidas no intestino delgado, penetrando na corrente sanguínea. Por esses motivos, a sacarose é uma fonte de energia química rápida (com um conteúdo calórico de 17 kJ/g) e causa, logo após sua ingestão, a subida dos níveis sanguíneos de glicose. A partir do gráfico a seguir (ln k × 1/T), em que k representa a constante de velocidade da reação e T, a temperatura absoluta, é possível determinar um dos parâmetros de Arrhenius, isto é, a energia de ativação, Ea , para a hidrólise ácida da sacarose. Considere-se que a velocidade da reação dependa exclusivamente da concentração de sacarose e observe-se que dois pontos da reta são mostrados no gráfico.
Considerando-se que a constante universal dos gases vale 8,3145 J·K-1· mol-1 , é correto concluir que o valor da energia de ativação da hidrólise ácida da sacarose é
- A.
inferior a 80 kJ/mol.
- B.
superior ou igual a 80 kJ/mol e inferior a 90 kJ/mol.
- C.
superior ou igual a 90 kJ/mol e inferior a 100 kJ/mol.
- D.
superior 100 kJ/mol.
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
No método de titulação, a solução cuja concentração é conhecida, chama-se solução-padrão. Para que uma substância seja considerada um padrão primário, ela deve atender a alguns requisitos necessários e outros desejáveis. É condição sine qua non, por exemplo, que a substância tenha alta pureza. Entre as condições desejáveis, está a de que ela deve ter elevada massa molar. Assinale a opção em se justifica a necessidade de o padrão primário atender a esse critério desejável.
- A.
Substâncias de elevada massa molar são geralmente de fácil purificação.
- B.
Substâncias de elevada massa molar reagem em uma proporção estequiométrica.
- C.
Substâncias de elevada massa molar minimizam erros de pesagem.
- D.
Tais substâncias são, em geral, higroscópicas.
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008

O eletrodo de vidro, mostrado na figura acima, é um bulbo, construído em vidro especial, que contém uma solução de concentração fixa (0,1 mol/L ou 1 mol/L) de ácido clorídrico (HCl) ou uma solução tamponada de cloreto em contato com o eletrodo de referência interno, normalmente constituído de prata revestida de cloreto de prata, o que assegura um potencial constante na interface entre a superfície interna do sensor e o eletrólito. O elemento sensor do eletrodo, situado na extremidade do bulbo, é constituído por uma membrana de vidro que, hidratada, forma uma camada de gel, externa, seletiva de íon hidrogênio. Essa seleção é, de fato, uma troca de íons sódio por íons hidrogênio, os quais formam uma camada sobre a superfície do sensor. Além disso, ocorrem forças de repulsão de ânions por parte do silicato, negativamente carregado, que está fixo no sensor. Ocorre, na camada externa do sensor, a geração de um potencial que é função da atividade do íon hidrogênio na solução. Com relação ao eletrodo de vidro, assinale a opção incorreta.
- A.
Eletrodos de vidro estão sujeitos tanto a erros ácidos quanto a erros básicos.
- B.
Íons hidrogênio migram através da membrana de vidro para produzir a diferença de potencial.
- C.
Eletrodos de vidro são suscetíveis a diminuição da sensibilidade, resposta lenta e erros de leitura, devido a riscos, arranhões, deterioração ou acumulação de resíduos sobre a superfície do vidro.
- D.
O "rejuvenescimento" de eletrodos de vidro pode ser feito por meio do tratamento cíclico ácido-álcali, que consiste na imersão, por sucessivas vezes, do sensor em soluções ácida e básica.
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
Os métodos potenciométricos analíticos são baseados em medidas de potencial de células eletroquímicas. Um desses métodos é a titulação potenciométrica, que consiste no acompanhamento dos vários estágios e na determinação do ponto final de um processo de titulação por intermédio da medida de pH. Nesse método, o ponto de equivalência é revelado por uma abrupta modificação do pH. Em geral, é necessário adotar um tratamento geométrico para fixar, com exatidão, o ponto final da titulação. Resultados mais satisfatórios são obtidos, entretanto, quando se empregam métodos matemáticos para localizar o ponto final. Assinale a opção em que o gráfico corresponde à 1.ª derivada da curva de titulação (pH versus volume de titulante adicionado).
- A.

- B.

- C.

- D.

Química - Reações, Soluções e Transformações Químicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2008
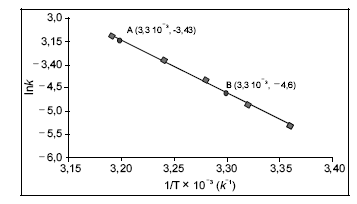
Uma substância de elevada inflamabilidade, que é usada para extração de óleo, gordura e também em termômetros de baixa temperatura, tem o seu espectro de massa apresentado na figura acima. Considerando-se que M(H) = 1 g/mol, M(C) = 12 g/mol, e M(O) = 16 g/mol, é correto afirmar que essa substância corresponde à fórmula
- A.
CH3 CH2 CH2 CH2 CH2 CH3 .
- B.
CH3 C(OH)CHCH2 CH3 .
- C.
CH3 CH2 CH2 COCH3 .
- D.
CH3 COCH(CH3 )2 .
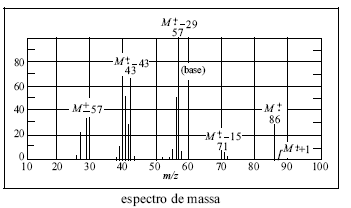
Entre as substâncias mostradas na figura acima, a que apresenta os níveis mais estáveis de energia dos orbitais moleculares (OM) é o
- A.
eteno.
- B.
1,3-butadieno.
- C.
1,3,5-hexatrieno.
- D.
benzeno.
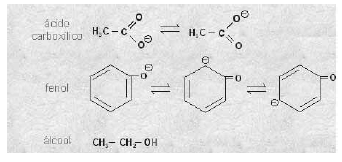
A figura acima apresenta três substâncias de grande importância comercial e suas respectivas estruturas de ressonância. Assinale a opção que apresenta, em ordem decrescente, a força ácida dessas substâncias.
- A.
álcool > fenol > ácido carboxílico
- B.
ácido carboxílico > fenol > álcool
- C.
fenol > álcool > ácido carboxílico
- D.
álcool > ácido carboxílico > fenol


