Questões de Química do ano 2009
Lista completa de Questões de Química do ano 2009 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
A concentração gravimétrica é fundamentalmente baseada na relação de queda livre ou impedida entre dois minerais, destacando-se a:
- A.
diferença de forma das partículas do mineral de interesse e dos minerais formadores da fase ganga;
- B.
diferença significativa entre a densidade do mineral de interesse e dos minerais da fase ganga;
- C.
susceptibilidade magnética dos minerais que constituem o minério;
- D.
forma das partículas minerais não liberadas;
- E.
cominuição seletiva de um minério.
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
A cominuição consiste na redução gradual do tamanho de um minério proveniente de uma mina e controle na produção de frações granulométricas do mesmo, podendo levar à liberação de um mineral de interesse do minério. Esta liberação consiste em:
- A.
gerar uma assembléia de partículas com tamanhos diferentes;
- B.
gerar uma assembléia de partículas contendo cada uma delas, predominantemente, uma fase mineral;
- C.
separar o mineral de interesse dos minerais que compõem a ganga;
- D.
reduzir o tamanho das partículas de um minério;
- E.
gerar uma assembléia mineral contendo partículas de diversos tamanhos e formas.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
O Brasil possui reconhecidas jazidas minerais portadoras de diversos minérios contendo óxidos, sulfetos e silicatos. Neste contexto, o minério itabirítico é essencialmente constituído dos seguintes minerais:
- A.
óxidos de cobre e pirita;
- B.
covelita e pirita;
- C.
óxidos de ferro e quartzo;
- D.
carbonato duplo de cálcio e magnésio e quartzo;
- E. silicatos de ferro e magnésio.

- A.
0;
- B.
3,2;
- C.
0,6;
- D.
1,8;
- E.
0,8.
Química - Elementos Químicos, Substâncias e propriedades químicas, Tabela Periódica - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
Os pontos de fusão e de ebulição das aminas são determinados pelas intensidades de suas interações intermoleculares. A tabela a seguir mostra as fórmulas bastão de três aminas com mesmo número de átomos de carbono:
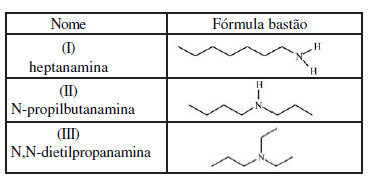
A ordem dos pontos de ebulição dessas aminas é:
- A.
I > II > III;
- B.
III > II > I;
- C.
II > III > I;
- D.
I > III > II;
- E.
I < II < III.
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
A ionização do H2SO4 em água produz as seguintes reações de equilíbrio:
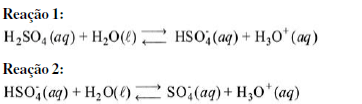
Segundo a teoria de ácidos e bases de Brönsted-Lowry, as espécies a seguir podem ser definidas como:
- A.
HSO4 − como ácido na Reação 1 e na Reação 2;
- B.
H2O como ácido Reação 1 e como base na Reação 2;
- C.
H3O+ como ácido Reação 1 e como base na Reação 2;
- D.
HSO4 − como base na Reação 1 e como ácido na Reação 2;
- E.
H2SO4 como ácido Reação 1 e H3O+ como base na Reação 2.
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
Um dos riscos da utilização do hidrogênio como combustível veicular é sua liberação acidental, pois a reação entre o hidrogênio gasoso e o oxigênio atmosférico é uma reação explosiva:

- A.
2 g e 32 g;
- B.
4 g e 16 g;
- C.
5 g e 80 g;
- D.
10 g e 320 g;
- E.
20 g e 160 g.
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
A reação de esterificação entre o 1-propanol e o ácido etanóico produz:
- A.

- B.

- C.

- D.

- E.

Um hidrocarboneto alifático saturado apresenta a seguinte fórmula bastão
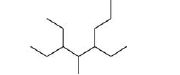
O nome oficial (IUPAC) deste composto orgânico é:
- A.
1,1,3-trietil-2-metil-hexano;
- B.
3,5-dietil-4-metil-octano;
- C.
4,6-dietil-5-metil-octano;
- D.
2-etil-4-metil-5-propil-heptano
- E.
5-etil-4-metil-3-propil-heptano;
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
O ácido nítrico (ácido forte) e o hidróxido de bário (base forte) apresentam, respectivamente, as seguintes dissociações iônicas em solução aquosa:

- A.
5,00;
- B.
10,0;
- C.
50,0;
- D.
100
- E.
200


