Questões de Química do ano 2009
Lista completa de Questões de Química do ano 2009 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
A reação no estado gasoso entre as substâncias A e B pode seguir dois caminhos concorrentes de etapa única:

Deste modo, podemos estimar que:
- A.
não há favorecimento energético entre as formações de C e D;
- B.
a formação de C é favorecida cineticamente e termodinamicamente;
- C.
a formação de D é favorecida cineticamente e termodinamicamente;
- D.
a formação de C é favorecida cineticamente e a formação de D é favorecida termodinamicamente;
- E.
a formação de C é favorecida termodinamicamente e a formação de D é favorecida cineticamente.
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
Uma das etapas do processo de fabricação do ácido sulfúrico é a obtenção do trióxido de enxofre (SO3) a partir da reação em fase gasosa do dióxido de enxofre (SO2) e com o oxigênio (O2). Esta reação estabelece o equilíbrio químico:

- A.
a presença de um catalisador;
- B.
o aumento da pressão e o aumento da temperatura;
- C.
o aumento da pressão e a diminuição da temperatura;
- D.
a diminuição da pressão e o aumento da temperatura;
- E. a diminuição da pressão e a diminuição da temperatura.
Química - Reações, Soluções e Transformações Químicas - Núcleo de Computação Eletrônica UFRJ (NCE) - 2009
A tabela a seguir relaciona a energia média necessária para romper um mol de ligações químicas para produzir átomos isolados.

O valor estimado, em kJ.mol−1, para o ΔH desta reação, a 25 ºC e 1 atm, é:
- A.
-781
- B.
-448;
- C.
-14;
- D.
+767;
- E.
+1.215.
A característica de eficiência de um instrumento analítico, expressa pela concentração ou pela massa mínima de analito presente em uma amostra, que pode ser detectada em um nível conhecido confiável, é definida pelo termo
- A.
precisão.
- B.
sensibilidade
- C.
seletividade.
- D.
limite de detecção.
- E.
limite de quantificação.
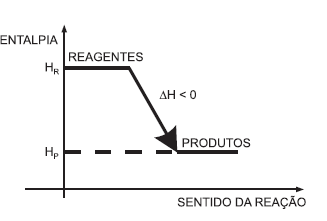
Com base no diagrama acima e considerando a variação de energia nas reações químicas, analise as afirmativas a seguir.
I A quantidade de calor necessária para que 1 grama de água passe de 14,5 oC para 15,5 oC define o conceito da unidade Caloria (cal).
II Um elemento químico apresenta entalpia igual a zero, quando, a 25 oC e 1 atm, está em seu estado físico usual e na forma alotrópica mais estável.
III O diagrama representa uma reação exotérmica que, ao ocorrer, libera calor para o meio.
IV A Lei de Hess estabelece que a variação de entalpia ( H) em uma reação química depende apenas dos estados inicial e final da reação.
Estão corretas as afirmativas
- A.
I e III, apenas.
- B.
II e IV, apenas.
- C.
I, II e III, apenas.
- D.
I, III e IV, apenas.
- E.
I, II, III e IV.
Os sistemas de tratamento de efluentes industriais são constituídos por processos e operações que empregam princípios físicos, químicos e biológicos para a remoção dos contaminantes. Os processos biológicos utilizam reações bioquímicas para remover contaminantes orgânicos solúveis ou coloidais e podem ser aeróbios ou anaeróbios. Um exemplo de processo que emprega os princípios biológicos descritos é
- A.
separação de água e óleo.
- B.
flotação a ar dissolvido.
- C.
coagulação/floculação.
- D.
sedimentação primária.
- E.
lodos ativados.
O tratamento da água para uso em sistemas de geração de vapor compreende uma etapa inicial de clarificação da água, que é sucedida por processos avançados de remoção de impurezas, a fim de evitar problemas como incrustações e corrosão. Um desses processos consiste na remoção dos sais catiônicos, de cálcio e magnésio, determinantes da dureza da água, através da passagem por um leito de resina catiônica. Tal processo é conhecido como
- A.
desinfecção.
- B.
neutralização.
- C.
ultrafiltração
- D.
abrandamento
- E.
osmose reversa.
Foram adicionados 200 mL de solução 0,5 N de NaOH a 600 mL de uma outra solução de NaOH 0,1 M. Qual é a massa de NaOH, em gramas, contida na solução formada após a mistura? (Dados: Massas atômicas: H = 1; O = 16; Na = 23)
- A.
3,2
- B.
6,4
- C.
8,4
- D.
12,0
- E. 12,8
Considere os compostos orgânicos relacionados abaixo e suas propriedades.
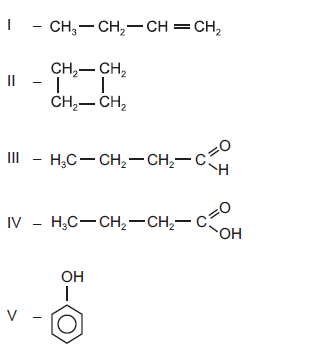
Qual das afirmações a seguir faz uma análise correta desses compostos?
- A.
Os compostos I e II são isômeros.
- B.
Os compostos II e V apresentam cadeia carbônica cíclica e saturada.
- C.
O composto III é chamado ácido butanoico e o composto IV, butanal.
- D.
O composto V apresenta maior caráter ácido que o composto IV.
- E.
O resultado da substituição do grupamento OH do composto IV por um grupamento NH2 é uma amina.
No trabalho em laboratório, a prática de análise volumétrica requer a medida de volumes líquidos com elevada precisão. Dentre os aparelhos volumétricos listados abaixo, qual é o que apresenta maior precisão para transferir um determinado volume de uma solução de um recipiente para outro?
- A.
Béquer
- B.
Proveta
- C.
Erlenmeyer
- D.
Pipeta graduada
- E.
Pipeta volumétrica


